
题目列表(包括答案和解析)
3.用铂电极电解下列溶液,当耗电量相同时,阴极和阳极上同时都有气体产生,且溶液的pH下降的是 ( )
A.H2SO4 B.CuSO4 C.HCl D.KCl
2.下列各组离子在指定条件下,-定能大量共存的是 ( )
A.使石蕊试液变红色的溶液中:K+、Na+、CO32-、NO3-
B.在酸性高锰酸钾溶液中:Na+、NH4+、I-、Br-
C. c(H+)=10-1mol/L的溶液中:Cu2+、Al3+、SO42-、NO3-
D.水电离出的c(H+)=10-12mol/L的溶液中:Na+、Mg2+、Cl-、SO42-
1.分别将下列各组物质等体积混合,在室温下剧烈振荡,静置后,能够形成均一溶液的是
( )
A.苯、碘水 B.苯酚、水 C.乙醇、水 D.乙酸乙酯、水
24.(8分))向NaBr与NaI的混合溶液中通入适量Cl2,反应完全后将溶液蒸干并小心灼烧至恒重,得固体W。
(1)W的可能组成为① ;② ;③ ;④ 。(填化学式,可以多填或少填)
(2)现将NaBr与NaI的混合固体10.0g溶于适量水中,通入448mLCl2(标准状况)充分反应后,按上述操作得到W的质量为7.28g。则原混合物中NaI质量分数为 。
大庆铁人中学2008~2009学年度第一学期期中考试
23.(10分) 以A为原料在化学工业上可制得多种物质,其中的一部分如图所示。A、B、D、E、G的焰色均呈黄色,A是由同周期元素组成的离子化合物,其水溶液呈中性,B、D、E的水溶液均呈碱性。常温下,X2为黄绿色气体。当G转化为D或E时,同时生成能支持燃烧的无色气体Y2。
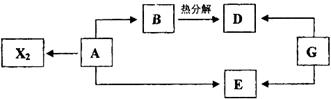
试回答下列问题:
(1)G的名称为 ,A的电子式为 ,E中的化学键类型为 。
(2)工业上以A为原料制取E的离子方程式为 。
(3)B溶液呈碱性的理由是(用离子方程式表示) 。
(4)在X、Y两种元素组成的某种化合物中,Y元素的质量分数为47.4%。该化合物与NaOH反应生成两种含氧酸盐,其中X的化合价分别为+3价和+5价,反应的化学方程式为:
。
22.(8分)有原子序数依次增大的六种短周期主族元素A、B、C、D、E、F。其中A与D、B与E分别同主族,B原子最外层电子数为内层电子数的2倍;F元素的原子半径在所在周期的主族元素中最小;C与A、D都可形成两种化合物,且所形成的化合物中各有一种具有漂白性。B、E分别与C形成的化合物晶体类型不同。试回答下列问题。
(1)B、C形成的所有原子都满足8电子结构的化合物的结构式为 。
(2)E单质的晶体类型是________________。
(3)写出以上六种元素形成的含18个电子的分子式 (任写三种)。
(4)已知几种元素之间形成的化学键的键能如下:
|
化学键 |
A-A |
A-F |
B-E |
C-E |
E-E |
E-F |
|
键能(kJ/mol) |
436 |
431 |
347 |
460 |
176 |
360 |
工业上用含有E、F两种元素(原子个数比为1∶4)的化合物在高温下与A单质反应来得到高纯度的单质E。则该反应的热化学方程式为:__________________ _________。
21.(8分)氯酸是一种强酸,氯酸溶液浓度若超过40%就会迅速分解,产生一种酸性比它更强的酸,同时放出气体,该混合气体干燥后的平均相对分子质量为45,它可以使带有火星的木条复燃,又可以使湿润的淀粉碘化钾试纸变蓝后又褪色。试写出:
(1)气体与湿润的淀粉碘化钾试纸发生反应的离子方程式 。
(2)氯酸分解的化学方程式 。
(3)生成1mol更强酸时,转移电子的物质的量是 ,生成气体在标准状况下的体积为 L。
20.(12分)某研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为: Ca(ClO)2+CaCl2+2H2SO4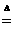 2CaSO4+2Cl2↑+2H2O他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O他们设计了如下制取氯气并验证其性质的实验。
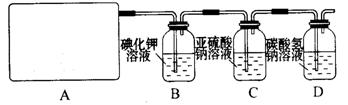
试回答:
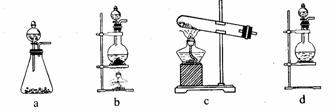
(1)该实验中A部分的装置是 (填写装置的序号)。
(2)请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):
。
(3)写出D装置中发生反应的离子方程式 。
(4)该实验存在明显的缺陷,请你提出改进的方法 。
(5)该小组又进行了如下实验:称取漂白粉2.0g,研磨后溶解,配置成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中Ca(ClO)2的质量分数为 (保留到小数点后两位)。
19.(10分) A、B、C、D、E均为可溶于水的固体,所得的溶液只有E溶液有颜色。取一定量的固体C放在试管中用酒精灯加热,固体的质量会减少。组成这五种物质的离子有(各物质所含的离子均不相同)
|
阳离子 |
Na+ Mg2+ Al3+ Ba2+ Fe3+ |
|
阴离子 |
OH- Cl- 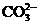 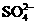 HCO3- HCO3- |
分别取它们的水溶液进行实验,结果如下:
①A溶液分别与其他四种溶液反应,均有沉淀;
②B溶液分别与其他四种溶液反应,也有沉淀;只是当B溶液加入到D溶液中时,先有沉淀继续加入B溶液时,沉淀会消失。
据此推断它们是A ;B ;C ;D ;E 。
18.根据下表下列叙述中正确的是 ( )
|
序号 |
氧化剂 |
还原剂 |
其它反应物 |
氧化产物 |
还原产物 |
|
① |
Cl2 |
FeBr2 |
|
|
FeCl3 |
|
② |
KMnO4 |
H2O2 |
H2SO4 |
O2 |
MnSO4 |
|
③ |
KClO3 |
HCl(浓) |
|
Cl2 |
Cl2 |
|
④ |
KMnO4 |
HCl(浓) |
|
Cl2 |
MnCl2 |
A.表中第①组反应的氧化产物一定只有FeCl3(实为Fe3+)
B.氧化性比较: KMnO4>Cl2>Fe3+>Br2>Fe2+
C.还原性比较: H2O2>Mn2+>Cl-
D.④的离子方程式配平后,H+的化学计量数为16
第Ⅱ卷(56分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com