
题目列表(包括答案和解析)
15.(10分)随着纳米材料在生产生活和科学研究中越来越广泛的应用,很多同学对其产生了浓厚的兴趣和探究的欲望。某化学学习小组通过查阅有关资料,按下列步骤自己动手
制备纳米铁粉。请结合实验操作回答相关问题。
⑴草酸亚铁晶体(FeC2O4·2H2O)的制备

①现有烧杯、玻璃棒、药匙、滤纸、托盘天平、胶头滴管等实验仪器,为配制上述两种溶液,缺少的玻璃仪器为 ,需称量FeSO4·7H2O g。
②过滤、洗涤过程中,检验草酸亚铁晶体是否洗净的方法是 。
③分析上述草酸亚铁晶体的制备方案,可推知FeC2O4·2H2O具备的性质是_________。
a.在水中溶解度较小 b.不稳定,受热易分解 c.白色固体 d.易被空气氧化
 ⑵纳米铁粉的制备
⑵纳米铁粉的制备
将一根长度约为12 cm-14cm的玻璃管在酒精喷灯上烧制成如图所示形状,向其中加入黄色草酸亚铁晶体。再将管口部分加热拉细,然后在酒精喷灯上均匀加热。当草酸亚铁粉末受热完全变黑,立即将管口拉细的部分放在火焰烧熔封闭,
这样便得到了高纯度的纳米铁粉。
①制备纳米铁粉,反应的化学方程式为__________________________________________。
②实验前无需排尽装置中的空气,原因是 。
14.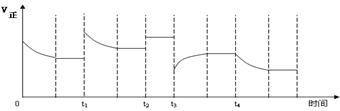 合成氨反应:N2(g)
+ 3H2(g)
合成氨反应:N2(g)
+ 3H2(g)  2NH3(g) △H=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如下图:
2NH3(g) △H=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如下图:
下列说法正确的是
A.t1时增大了压强
B.t2时使用了催化剂
C.t3时降低了温度
D.t4时增大了c(NH3)
第II卷(非选择题 共72分)
13.缓冲溶液可以控制少量酸碱对溶液pH的影响,NaH2PO4/Na2HPO4的混合溶液可以将体系的pH稳定在6.2-8.2。下列有关该缓冲溶液的说法正确的是
A.加入少量强碱,发生反应HPO42-+OH- PO43-+H2O
B.加入少量强酸,发生反应HPO42-+H+ H2PO4-
C.c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)
D.2c(Na+)>c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)>c(Na+)
12. 运动员禁服兴奋剂是08年北京奥运会“人文奥运、科技奥运、绿色奥运”的重要举措之一。关于下列两种兴奋剂的说法错误的是
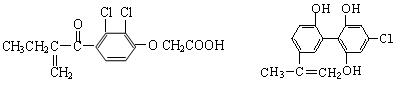
①利尿酸 ②兴奋剂X
A.利尿酸核磁共振氢谱有六个吸收峰
B.1 mol兴奋剂X与浓溴水和H2反应时最多消耗 Br2和H2分别为4mol、7mol
C.它们均为芳香族化合物且均能与小苏打溶液反应
D.可以用FeCl3溶液鉴别利尿酸和兴奋剂X
11.A、B、C均为短周期元素,A、B同周期, A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法中正确的是
A.C元素的最高正价为+7价 B.原子半径:A>B>C
C.离子半径:A2->C->B2+ D.还原性:A2-<C-
10.下列离子方程式表达正确的是:
A.氯化铝溶液中加入过量氨水:Al3+
+ 4NH3•H2O AlO2-+ 4NH4+ + 2H2O
B.氯化铁溶于水 : Fe3++3H2O Fe(OH)3+3H+
C.碳酸钙溶于醋酸:CaCO3
+ 2H+ Ca2+
+ CO2↑ + H2O
D.碳酸氢钙溶液中滴加过量烧碱:Ca2++2HCO3-+2OH- CaCO3↓+ 2H2O+ CO32-
9.设NA表示阿伏加德罗常数,下列说法正确的是
A.11.2L的CH4和NH3混合气体所含有的分子数目为0.5 NA
B.1.5 mol 的NO2与足量H2O反应,转移的电子数为NA
C.14g分子式为CnH2n的(n≥2)的链烃中含有的C=C的数目为
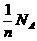
D.6.2g氧化钠和7.8g过氧化钠混合物中所含有的离子数为0.7 NA
8.用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160 kJ·mol-1
若在标准状况下用CH4还原4.48LNO2气体至N2,则下列说法中正确的是
A.转移的电子数为NA个
B.此过程中需要CH4气体3.36L
C.该过程放出的热量为86.7kJ
D.已知2NO(g)+O2(g) 2NO2(g) ΔH=-114 kJ·mol-1,则CH4的燃烧热是802kJ·mol-1
7.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
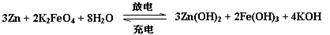
下列叙述错误的是:
A.放电时正极附近溶液的碱性增强
B.放电时每转移3 mol电子,正极有1mol K2FeO4被还原
C.充电时锌极与外电源负极相连
D.充电时阳极反应为:Fe(OH)3- 3e- + H2O FeO42-+5H+
6.下列关于有机物的叙述正确的是
A.CH4O与C3H8O一定是同系物
B.同分异构体一定具有相似的化学性质
C.等质量的苯和乙炔完全燃烧耗氧量相等
D.溴乙烷中滴加硝酸银溶液,产生浅黄色沉淀
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com