
题目列表(包括答案和解析)
23.用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
(1)图中D装置在实验中的作用是 。
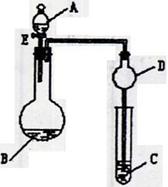 (2)若 A为30%H2O2溶液,B为MnO2
,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式为
。
(2)若 A为30%H2O2溶液,B为MnO2
,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式为
。
(3)若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开E后,C中的现象是 ;继续通气体于C中,足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被Cl2氧化为HIO3,写出该反应的离子反应方程式 。
 (4)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是
,C中发生反应的离子方程式为
。
(4)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是
,C中发生反应的离子方程式为
。
22. A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
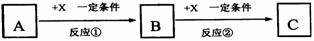
试回答:
(1)若X是强氧化性单质,则A不可能是 。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为 ;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示) 。
(3)若A、B、C为含金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为 ,X的化学式可能为(写出不同类物质) 或 ,反应①的离子方程式为
或 。
21.某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填入以下空格内。

(2)反应中,被还原的元素是_______,还原剂是____________。
(3)将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目。

(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为__________。
20.近年来,加“碘”食盐较多使用了碘酸钾,KIO3在工业上可用电解法制取,以石墨和铁为电极,以KI溶液为电解液在一定条件下电解,反应方程式为KI+3H2O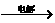 KIO3+3H2↑。下列有关说法正确的是( )
KIO3+3H2↑。下列有关说法正确的是( )
A 电解时,石墨作阴极,铁作阳极 。
B 电解时,在阴极附近的pH值变大。
C 电解后得到KIO3产品的步骤有:过滤→浓缩→结晶→灼烧
D 电解中每转移0.6mol电子,理论上可得到0.1mol无水KIO3晶体
卷Ⅱ 非选择题
19.2000年1月底,罗马尼亚一金矿污水处理池因降暴雨而发生裂口,10万升含氰化物和铅、汞等重金属的污水流入蒂萨河(多瑙河支流),造成该河90%以上的动植物死亡。这是继切尔诺贝利核泄漏以来,欧洲最严重的环境污染事件。氰气[(CN)2]和氰化物都是剧毒性物质,氰分子的结构式为N≡C-C≡N,性质与卤素相似,下列叙述错误的是( )
A 氰分子中四原子共直线,是非极性分子 B 氰分子中C≡N键长大于C≡C键长
C 氰气能与强碱溶液反应得到氰化物和次氰酸盐 D 氰化氢在一定条件下能与烯烃发生加成反应
18.可用于区别Na2S、Na2SO3、Na2SO4、Na2CO3、Na2SiO3 、Na2S2O3六种溶液的一种试剂是( )
A、NaOH B、盐酸 C、酚酞试液 D、BaCl2
17.在相同条件下进行0.24gMg与①0.2mol/L 80mL的盐酸;②0.2mol/L100mL的醋酸反应,下列说法错误的是( )
A.两个反应开始时的反应速率:V(HCl)大于V(CH3COOH)
B.反应进行完全产生的气体的物质的量:n(HCl)等于n(CH3COOH)
C.在上述盐酸溶液中加入少量的醋酸钠固体,不改变产生气体的物质的量,但能使该反应化学反应速率降低。
D.在上述醋酸溶液中加入少量硫酸铜溶液,可以加快化学反应速率,但气体的物质的量不发生改变。
16. 下列溶液中,微粒浓度关系正确的是( )
A.含有NH4+、Cl-、H+、OH-离子的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.pH=8的氨水与氯化铵的混合溶液中:c(Cl-)>c(NH4+)
C.0.1mol/L 的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)
D.pH=3的一元酸和pH=11的一元强碱等体积混合后的溶液中:c(OH-)=c(H+)
15. 某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3∶1。用石墨作电极电解该混合溶液时,根据电极产物,可明显分为三个阶段。下列叙述不正确的是( )
A.阴极自始自终只析出H2 B.溶液pH不断增大,最后为7
C.电解最后阶段为电解水 D.阳极先析出Cl2,后析出O2
14.下列化学反应的离子方程式正确的是( )
A.在稀氨水中通入过量CO2: NH3·H2O+CO2=NH4++HCO3-
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3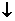 +2HClO
+2HClO
C.用稀HNO3溶液FeS固体:FeS+2H+=Fe2++H2S
D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO4
2- =CaSO4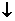 +H2O
+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com