
题目列表(包括答案和解析)
2.下列化学反应的离子方程式正确的是
A.在稀氨水中通入过量
B.少量SO2通入 溶液中:
溶液中: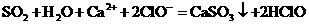
C.用稀NHO3溶解FeS固体:
D.氢氧化钙溶液与等物质的量的稀硫酸混合:
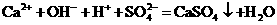
1.现有硫酸钠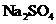 、
、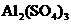 、
、 三种无色溶液,若用一种试剂将它们区别开来,该试剂可以是
三种无色溶液,若用一种试剂将它们区别开来,该试剂可以是
A.纯水 B.盐酸 C.硝酸银溶液 D.氢氧化钠
24.Ⅰ(2分)用18.4mol/L的浓H2SO4配制100mL浓度为1mol/L的稀H2SO4时 据此填写:
(1)进行量取浓H2SO4操作时,应选择下列量器是
 (填序号)
(填序号)
① 10mL量筒 ② 50mL量筒
③ 500mL量筒 ④ 1000mL量筒
如果对装有浓H2SO4的量筒读数如图所示读取,
配制的稀H2SO4的浓度将 (填
“偏高”、“偏低”或“无影响”)
Ⅱ(9分)如图(见答题纸)是实验室制取某种气体的制备、性质检验及收集装置图。
(1)写出图中A中反应的化学方程式:____________________________
写出A中反应物为非金属构成的离子化合物的电子式为______________________
(2)B装置的作用是_______ 。
(3)做喷泉实验前,要检验F装置是否充满气体,该操作及现象是___ ___。
(4)做喷泉实验时要关闭K2和K4,打开K1,此时C装置的作用有两点:
①吸收多余的气体保持气流通畅;②______ ___。
(5)验满气体后, 关闭K2和K4,打开K1.若要在E中引发喷泉,其操作为________;假设液体充满整个烧瓶,所得溶液的物质的量的浓度为____ _
23.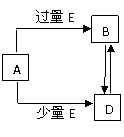 (5分)已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去)。
(5分)已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去)。
(1)若A和E为单质,组成A单质的元素是自然界中形成
化合物种类最多的元素。
①B属于 分子(填“极性”或“非极性”)
②写出由A单质制备两种不同的非金属单质的化学方
程式________________________
(2)若A为第三周期中的元素所形成的氯化物。
①写出A溶液→B的离子方程式
②写出A和B的溶液反应的离子方程式 。
22.(6分)A、B、C、D均为短周期主族元素,A、C、D在不同周期,A和C同主族,B、C同周期,A、B、C三种元素的原子序数之和为37,且B元素的最外层电子数与其电子层数相同。请回答:
(1)D元素的名称为 。
(2)元素A、D形成的化合物D2A的熔点比D2C的熔点 (用“高”或“低”填写),
理由是(请结合图示说明) 。
(3)A、B、C三种元素所形成的常见化合物溶于水呈酸性,用离子方程式表示其原因 。
(4)A、B、C、D四种元素的简单离子的半径从小到大的顺序是
(用元素符号表示)
21.(15分)
(1)白磷分子中的键角为 ,分子的空间构型为 ,若将1分子白磷中的所有P-P键打开并各插入一个氧原子,共可结合 个氧原子, 若每个P原子上的孤对电子再与氧原子形成配位键,就可以得到磷的另一种氧化物
(填分子式)。
(2)元素周期表是学习化学的重要工具之一,掌握其结构和递变规律是运用周期表的前提。
请按要求回答下列各题:
①写出下面各周期或族所包含的元素种数:第3周期________,第6周期_____ __,Ⅲ B族_________,如果周期表有第八周期,则该周期种元素种数为_________。
②已知A、B分别是周期表中同周期的II A族、III A族元素,原子序数分别为m和n,则n-m的值可能是_________。
(3)经验表明,除氢和氦外,当元素原子的电子层数(n)多于或等于原子最外层电子数(m)即(n-m)≥0时,该元素属于金属元素;当元素原子的最外层电子数(m)多于原子的电子层数(n)即(n-m)<0时,该元素属于非金属元素。试回答:
①第n(n≥2)周期有_______种主族金属元素,有______种非金属元素。
②根据周期表中每个周期非金属的种数,预测周期表中应有_______种非金属元素(含稀有气体),未发现的非金属处在_______周期______族。
20.把x mLCO2通过足量的Na2O2后再与y mL NO混合。x与y之和为30mL。设充分反应后气体的体积缩小为15mL,则x :y为 ( )
① 1 :1 ② 2 :1 ③ 5 :4 ④


 7 :5
7 :5
A.① B.② C.③ D.①②③④
Ⅱ卷(共54分)
19.下列离子方程式正确的是: ( )
A.等物质的量的Ba(OH)2与KAl(SO4)2·12H2O溶液混合:
3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
C.H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2↑
D.CuCl2溶液中加入NaHS溶液:Cu2++2HS-+2H2O=Cu(OH)2↓+2H2S↑
18.下列有关主族元素形成的离子的叙述正确的是 ( )
A.单核阳离子的电子层结构(除氢外)一定与上一周期稀有气体原子电子层结构相同
B.单核阳离子的电子层数一定比其原子的电子层数少
C.单核阴离子的半径一定比其原子半径大
D.除H – 外,单核阴离子最外层一定是8电子结构
17.下列指定微粒的个数比为2:1的是 ( )
A.Be2+离子中的质子和电子
B.T原子中的电子和中子
C.NaHCO3晶体中的阴离子和阳离子
D.CaO2(过氧化钙)固体中的阴离子和阳离子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com