
题目列表(包括答案和解析)
6.(1)Ge、Bi(2)Bi4Ge3O12(或Bi4(GeO4)3或2Bi2O3·3GeO2)(3)Bi2O3




5.①m=n+2②31③第3④VA⑤HPO3⑥H3PO4
4.(1)A硅;B氮;C硫;D砷;X磷(2)H2SO4>H3PO4>H3AsO4(3)NH3>PH3>SiH4
3.(1)碳酸锂,碳酸钠,碳酸铍,碳酸镁(2)mA/MA?mB/MB+mc/MC(或MB<MA<MC;MC<MA<MB以及其它合理答案 (3)2种Li2CO3MgCO3(4)MgCO3,BeCO3Na2CO31.05
2.(1)N2O5,N2O3(2)2Li+2H2O=2LiOH+H2↑(3)PH3<NH3
1.(1)CH4>NH3,H2S>HCl(2)>,>(3)CFCl3(或CF3Cl)(4)使大气臭氧层出现空洞a
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
A |
C |
C |
B |
C |
B |
A |
A |
C |
C |
C |
B |
D |
D |
CD |
A |
B |
B |
|
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
31 |
32 |
33 |
34 |
35 |
|
|
AB |
C |
AD |
B |
D |
B |
C |
C |
BC |
D |
A |
A |
C |
C |
A |
B |
A |
|
29.(10分)某硫酸厂在进行黄铁矿(主要成分是FeS2)成分测定时,取0.1000g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应,再用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL。
已知:①SO2+2Fe3++2H2O=SO2-4+2Fe2++4H+
② Cr2O2-7+ Fe2++ H+= Cr3++ Fe3+ H2O
(1)在反应②的横线上填写相应的化学计量数。
(2)灼烧6g纯FeS2时放出42.65kJ热量,写出灼烧FeS2的热化学方程式:
。
(3)反应②中1mol氧化剂 (填“得到”或“失去”) mol电子。
(4)样品中FeS2的质量分数(假设杂质不参加反应) 。
28.(12分)下面是测定硫酸铜晶体水含量的实验,请按要求填空。
(1)加热前应将晶体放在研钵研碎,加热是放在 中进行,加热失水后,应放在 中冷却。
(2)判断是否完全失去结晶水的方法是 。
(3)下面是某同学的一次实验数据,请完成计算,将答案填入表中的空格中。
|
坩埚质量 |
坩埚与晶体总质量 |
加热后坩埚与固体总质量 |
测得晶体中结晶水的个数 |
误差(填“偏高”或“偏低”) |
|
11.7g |
22.7g |
18.6g |
|
|
(4)这次实验产生误差的原因可能是 (填字母的序号)。
A.硫酸铜晶体中含有挥发性的杂质
B.加热过程中有晶体溅出
C.实验前晶体表面有湿存水
D.最后两次称量质量相差较大
27.(12分)氯碱厂电解饱和食盐制取NaOH的工艺流程示意图如下:
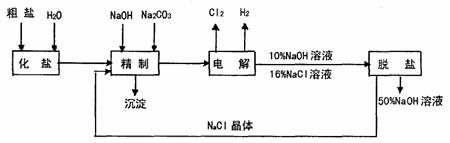
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生的电极反应式为
,与电源负极相连的电极附近溶液pH (填“不变”、“升高”或“降低”)
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为
。
(3)如果粗盐中SO2-4含量较高,必须添加钡试剂除去SO2-4,该试剂可以是 (填字母序号)。
a.Ba(OH2) b.Ba(NO3)2 c.BaCl2
(4)为有效去除Ca2+、Mg2+、SO2-4,加入试剂的合理顺序为 (填字母序号)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.衔加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、 (填操作名称)除去NaCl。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com