
题目列表(包括答案和解析)
20.甲、乙、丙、戊都具有如图所示的结构单元,图中正四面体以外可能有部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同。已知:
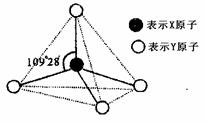 ①甲、乙是同一类晶体中各自结构单元,单质甲能与乙发生置换反应
①甲、乙是同一类晶体中各自结构单元,单质甲能与乙发生置换反应
②丙、丁、戊三种粒子含有等量的电子数,其中
丙、丁是同一类晶体中的分子或分子集团
③常温下丁呈液态,能产生两种等电子数的粒子
④戊是阳离子
(1)甲与乙发生置换反应的化学方程式是 。
(2)写出液态丁产生两种等电子粒子的电离方程式 。
(3)丙是目前重要的能源,丙和丁在催化、加热条件下得到两种可燃性的气体,其反应的化学方程式是 。
19.某化学反应的反应物和产物如下:
A1+NaNO3+H2O→A1(OH)3+N2+NaAlO2
(1)该反应的氧化剂是 。
(2)该反应的氧化产物是 。
(3)反应过程中转移5mole-,生成标况下N2的体积 L。
(4)配平该反应的化学方程式:
A1+ NaNO3+ H2O→ A1(OH)3+ N2+ NaAlO2
18.某溶液中只可能含有下列离子中的几种(不考虑溶液中含的较少的H+和OH-)Na+、NH4+、SO42-、CO32-、NO3-。取200mL该溶液,分为等体积的二份分别做下列实验。实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL。实验2:第二份先加入足量的盐酸,无现象,再加足量的BaCl2溶液,得固体2.33克。下列说法正确的是
A.该溶液中可能含有Na+
B.该溶液中肯定含有NH4+、SO42-、CO32-、NO3-
C.该溶液中一定不含NO3-
D.该溶液中一定含Na+,且c(Na+)≥0.1 mol/L
|
第Ⅱ卷(非选择题,共55分)
17.0.1 mol·L-1的NH4HSO4溶液与0.1mol·L-1的NaOH溶液等体积混合,下列关于混合后溶液中离子浓度关系的表述正确的是( )
A、c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH -)
B、c(Na+)=c(SO42-)>c(NH4+)> c(OH -)> c(H+)
C、c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH -)
D、c(Na+)=c(SO42-)=c(NH4+)>c(H+)>c(OH -)
16. 已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1mol·L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度的下列关系中(R表示S或C),一定正确的是( )
A、c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B、c(Na+)+ c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C、c(H+)+ c(H2RO3)=c(RO32-)+c(OH-)
D、两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
15. 下列反应的离子方程式错误的是( )
A、向碳酸氢钙溶液中加入少量的氢氧化钠溶液 Ca2++HCO3- +OH - =CaCO3↓+H2O
B、等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合
Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3·H2O+H2O
C、氢氧化铝与足量氢氧化钠溶液反应 Al(OH)3+OH-=AlO2-+2H2O
D、乙酸溶液与氢氧化钠溶液混合 OH-+H+=H2O
14.下列有关实验操作的叙述不正确的是 ( )
A.用干燥、洁净的玻璃棒醮取待测液滴在 pH试纸(置于表面皿内)上测溶液的pH
B.烧瓶、锥形瓶、蒸发皿加热时都要垫石棉网
C.制备Fe(OH)3胶体时,应往沸水中加饱和FeC13溶液,并继续加热至溶液呈现红
褐色为止
D.在中学“硫酸铜晶体里结晶中含量的测定”的实验中,至少需要进行四次称量操作
13. 右图表示不同温度(T)和压缩(P)对可逆反应2L(g)
2M(g)+N(g);△H>0影响情况,已知P2>P1,则图中纵轴表示的意义可能是 ( )
右图表示不同温度(T)和压缩(P)对可逆反应2L(g)
2M(g)+N(g);△H>0影响情况,已知P2>P1,则图中纵轴表示的意义可能是 ( )
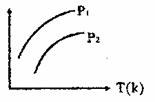 ①一定条件下L的转化率
①一定条件下L的转化率
②混合气体中M的百分含量
③混合气体中L的百分含量
④混合气体中的平均相对分子质量
A.①② B.①③
C.②④ D.③④
12.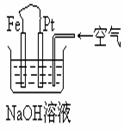 有关右图装置中的叙述正确的是
有关右图装置中的叙述正确的是
A.这是电解NaOH溶液的装置
B.这是一个原电池装置,利用该装置可长时间的观察到
Fe(OH)2 沉淀的颜色
C.Pt为正极,其电极反应为:O2+2H2O +4e-=4OH-
D.Fe为阳极,其电极反应为:Fe-2e-+2OH-=2Fe(OH)2
11.下列说法正确的是 ( )
A.室温下0.1mol/L的NaHCO3溶液中,若pH>7,则c(CO32-)>c(H2CO3)
B.相同条件下,等物质的量浓度的NH4C1和NH4HSO4溶液,前者溶液中NH4+浓度较
小
C.在室温下,某溶液中由水电离出的c(H+)=10-3mol/L,则此溶液可能是盐酸溶液
D.加水稀释稀醋酸溶液,溶液中所有离子浓度都会减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com