
题目列表(包括答案和解析)
5.下列各组离子,一定能大量共存的是
A.常温下,c(H+)/c(OH-)=1×10-12的溶液:I-、Cl-、HCO3-、Na+
B.含有大量Fe3+的溶液:Na+、HCO3-、NO3-、CO32-
C.加入铝粉能产生氢气的溶液:Cl-、Na+、SO42-、NO3-
D.由水电离出的c(H+)=1×10-12 mol•L-1溶液中:K+、Cl- 、NO3- 、Na+
4.下列标注或操作正确的是

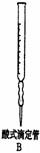
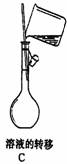
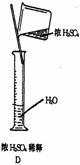
3.设NA为阿伏加德罗常数的值,下列说法中正确的是
A.标准状况下,22.4 L三氯甲烷中共价键数目为4NA
B.1mol Na2O2与足量的CO2和H2O(g)的混合物反应,转移的电子数为NA
C.足量MnO2与含4 mol HCl的浓盐酸反应生成的Cl2分子数为NA
D.1mol Cl2溶于水中转移的电子数为NA
2.下列化学用语或模型表示正确的是
A.次氯酸的结构式为:H-Cl-O B.CO2分子比例模型
C.丙烯的结构简式:CH3CH2CH2 D.HCN的电子式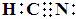
1.生物柴油是以果实、种子、植物油或动物脂肪、废弃的食物油等为原料,经酯交换反应制得的脂肪酸单烷基酯。下列关于生物柴油的叙述不合理的是
A.生物柴油含硫量低,可减少二氧化硫的排放
 B.生物柴油在一定条件下可发生水解
B.生物柴油在一定条件下可发生水解
C.生物柴油推广不符合“绿色化学”
D.生物柴油是一种可再生能源
10.(共l4分)二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合
治理其污染是环境化学当前的重要研究内容之一。
(1)在火力发电厂产生的废气中含有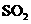 、
、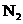 、
、 等气体,为除去
等气体,为除去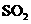 ,常用Ca(OH)
,常用Ca(OH)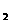 ,悬浊液洗涤废气,为了达到废物利用的目的,再通入空气使反应产物转化为石膏
,悬浊液洗涤废气,为了达到废物利用的目的,再通入空气使反应产物转化为石膏
(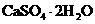 )。写出有关的化学反应方程式
。
)。写出有关的化学反应方程式
。
 (2)硫酸工业生产中,
(2)硫酸工业生产中,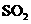 催化氧化生成
催化氧化生成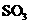 ;
;
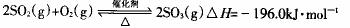
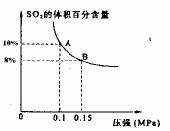
某温度下达到平衡时,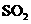 的体积百分含量与体系的
的体积百分含量与体系的
总压强的关系如右图所示,则平衡状态由A变到B时,
反应体系 (填“吸收”或“释放”)能量。
(3)①汽车尾气中主要含有 、N0
、N0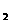 、S0
、S0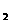 、C0
、C0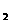 气体,其中 能导致酸雨的形成;目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化。
气体,其中 能导致酸雨的形成;目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化。
如: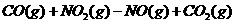 △H=-akJ·mol
△H=-akJ·mol (a>O)
(a>O)
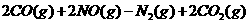 △H=-bkJ·mol
△H=-bkJ·mol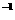 (n>O) 据此回答:若用标准状况下3.36 LC0还原N0:至
(n>O) 据此回答:若用标准状况下3.36 LC0还原N0:至 (CO完全反应)的整个过程中转
(CO完全反应)的整个过程中转
移电子的物质的量为 mol,放出的热量为 kJ(用含有a和b的代数式表示)。
②汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度: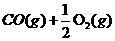

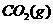
a.某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关
系如下表所示。请填写表中的空格。

b.相同温度下,某汽车尾气中C0、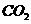 的浓度分别为
的浓度分别为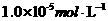 和
和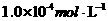 。
。
若在汽车的排气管上增加一个补燃器,不断补充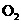 并使其浓度保持为
并使其浓度保持为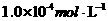 ,则最终尾气中C0的浓度为
,则最终尾气中C0的浓度为 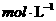 (请保留两位有效数字)。
(请保留两位有效数字)。
9.(共18分)Ⅰ.化学是一门以实验为基础的自然科学,实验中正确的操作、读数实验成功
的关键。对以下实验结果进行分析,用“大于”“等于”“小于”填空
(1)读量筒中液体的体积时,俯视,读取的体积数 实际体积数
(2)用托盘天平称取10.4g食盐,将砝码和食盐的位置颠倒,所称食盐的质量10.4g
(3)配制500mL0.1mol/LNaOH溶液,定容时仰视刻度线,所得溶液的物质的量浓度
0.1mol/L
(4)用中和滴定法测某NaOH溶液的浓度,量取待测液未用该溶液润洗滴定管,测得的溶
液的浓度 实际浓度
Ⅱ.为比较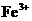 和
和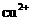 对
对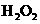 分解的催化效果,某化学研究小组的同学分别设计了如图
分解的催化效果,某化学研究小组的同学分别设计了如图
甲、乙所示的实验。请回答相关问题:
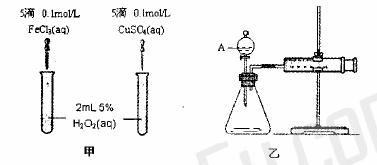
(1)定性分析:如图甲可通过观察
,定性比较得出结论。有同学提出将 改为
改为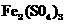 更为合理,其理由是
更为合理,其理由是
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均
已忽略。图中仪器A的名称为 ,检查该装置气密性的方法是 ,实验中需
要测量的数据是 。
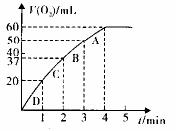
(3)加入0.10mol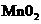 粉末于50 mL
粉末于50 mL 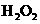 溶液中,在标准状况
溶液中,在标准状况
下放出气体的体积和时间的关系如图所示。
①写出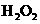 在二氧化锰作用下发生反应的化学方程式 。
在二氧化锰作用下发生反应的化学方程式 。
②实验时放出气体的总体积是 mL ③放出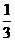 气体所需时间为 min
气体所需时间为 min
④A、B、C、D各点反应速率快慢的顺序为 > > >
⑤解释反应速率变化的原因
⑥计算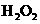 的初始物质的量浓度
mol/L(请保留两位有效数字)
的初始物质的量浓度
mol/L(请保留两位有效数字)
8.(共18分)现有一种有机物A,分子式为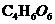 对于A的结构与性质实验结论如下
对于A的结构与性质实验结论如下
i A的分子中有两个羧基;
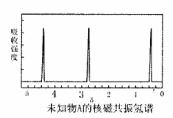
ii A的核磁共振氢谱如右图所示;
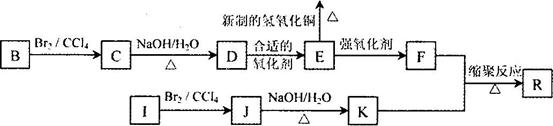
下图是利用烃8与烃I合成有机物A和一种高
分子新材料R的转化关系示意图.已知烃I的相对
分子质量为28,且F的相对分子质量比E多28。
已知:①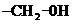 优先被氧化于
优先被氧化于
②同一个碳原子上连有多个羟基的结构极不稳定,不予考虑。
请分析并按要求回答下列问题:
(1)写出A对应的结构简式 ;B物质的名称 ;
E中所含官能团的名称 、
(2)写出对应反应的化学方程式:
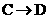 ;反应类型为
;反应类型为
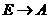
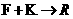
(3)有机物E的同分异构体M满足下列三个条件:
①1 mol有机物与银氨溶液充分反应生成2 molAg
②1 mol有机物与足量 ,溶液反应产生lmol
,溶液反应产生lmol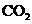
③1 mol有机物与足量金属Na反应产生l mol 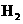
请判断M的结构可能有 种,任写一种M的结构简式
6.如下图所示的装置,C、D、E、F都是惰性电极。将电源
接通后,向(乙)中滴人酚酞溶液,在F极附近显红色。则以
下说法正确的是
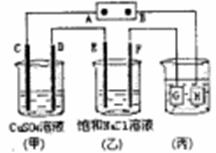
A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量比为l:2:3:2
C.欲用(丙)装置给铜镀银.G应该是Ag,电镀液是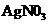 溶液
溶液
D.装置(乙1中电解的离子方程式为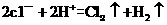
理科综合(化学部分)第2页共6页
2010年天津市十二所重点中学高三毕业班联考(二)
理科综合能力测试化学部分
第Ⅱ卷
的2倍,D与G为同族元素,F的电子层数与最外层电子数相等,A与D可形成四核18电
子的微粒。请回答下列问题:
(1)写出元素B的名称
(2)A与D形成化合物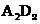 的电子式 ,E与G形成化合物
的电子式 ,E与G形成化合物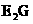 的化学键类型为
的化学键类型为
(3)写出A、B、D、E四种元素组成的化合物中原子个数最少的化合物的化学式为
(4)C的最高价氧化物对应的水化物与其氢化物反应生成一种盐X,X的水溶液显
(填“酸”、“碱”或“中”)性,理由是(用离子方程式表示)
(5)写出F与E的最高价氧化物对应的水化物反应的化学方程式
(6)G的某种氧化物可使酸性高锰酸钾溶液褪色,写出该反应的离子方程式
(7)M、N代表两种不同物质,都是由A、B、D、E中的任意三种元素组成的化合物,已知其
水溶液都显碱性,温度一定时.相同浓度的M溶液中水的电离程度小于N溶液中水的电
离程度,则M的化学式为 ,N的化学式为 ,M溶液中水的电离程度小于N溶液中
水的电离程度的原因是
理科综合(化学部分)第3页共6页
5.常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.某物质的溶液中由水电离出的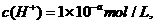 若a>7时,则该溶液的pH一
若a>7时,则该溶液的pH一
定为l4-a
B.在饱和氯水中加入NaOH使pH=7,所得溶液中存在下列关系:
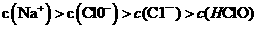
C.pH=5的稀盐酸加水稀释l000倍后所得溶液中: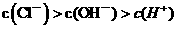
D.常温下,0.1mol/LNaB溶液的pH=8,将该溶液与0.06mol/L的盐酸等体积混合(忽
略体积变化)后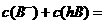 0.05mol/L
0.05mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com