
题目列表(包括答案和解析)
1、下列说法错误的是( )
A、实验室中少量金属钠通常保存在煤油中。
B、光线通过时,胶体可产生丁达尔效应。
C、氧气、液氯是单质,氯水、氯化氢、纯碱是化合物。
D、“只要工夫深,铁杵磨成针” 只涉及物理变化。
31、某工厂以精辉铜矿(主要成分为Cu2S)为原料冶炼铜,在炼铜炉内发生如下反应(在高温条件下进行):
2 Cu2S+3O2®2Cu2O+2 SO2 2Cu2O+Cu2S®6Cu+SO2
(1) 若生成38.4吨金属铜,需要含杂质20%的精辉铜矿多少吨?(设杂质不参加反应)
(2) 若(1)中产生的二氧化硫用于生产硫酸,可生产98%的硫酸多少吨(二氧化硫转化成三氧化硫的转化率为92%,三氧化硫的吸收率为98%)?(保留3位小数)
(3) 今将a mol Cu2S与b mol空气(氧气约占空气体积的20%)在密闭容器中高温加热,设反应前容器内的压强为P1,反应结束后冷却到原来的温度,容器内的压强为P2,请完成下列表格:
|
反应后固体的成分 |
Cu |
Cu2S、Cu |
Cu2O、Cu |
|
b的取值范围 |
|
|
|
|
P1与P2的关系 (填>、<、=) |
P1 P2 |
P1 P2 |
P1 P2 |
30、钙是人体神经、肌肉、骨骼系统、细胞膜和毛细血管通透性的功能正常运作所必需的常量元素,维生素D参与钙和磷的代谢作用,促进其吸收并对骨质的形成和改善有重要的作用。某制药有限公司生产的“钙尔奇D600片剂”的部分文字说明如下:“本品每片含主要成分碳酸钙1.5 g (相当于钙元素600 mg),成人每天服用1片。”
(1) “1.5 g碳酸钙与600 mg的钙”的计量关系是如何得出来的,请写出简要步骤。
(2) 该公司的另一种产品,其主要成分与“钙尔奇D600”相同,仅仅是碳酸钙的含量不同。为测定该片剂中碳酸钙含量,某学生进行了如下实验:取10片该片剂碾碎后放入足量的HCl中经充分反应(假设该片剂的其余部分不与HCl 反应)过滤,取滤液加(NH4)2C2O4,使Ca2+ 生成CaC2O4沉淀,沉淀过滤洗涤后溶解于强酸中,并稀释成1 L溶液,取其20.0 mL,然后用0.0500 mol/LKMnO4 溶液滴定,反应中用去12 .0 mL KMnO4溶液,发生的离子反应为:
2MnO4― +5H2C2O4 +6H+  2Mn2+ +10CO2↑+8H2O
2Mn2+ +10CO2↑+8H2O
①请通过计算回答该片剂中碳酸钙的含量。
② 参照上述关于“钙尔奇D600片剂”的文字说明,你认为该片剂的名称应该叫“钙尔奇
D_______片剂”。
28、下列是八种环状的烃类物质:
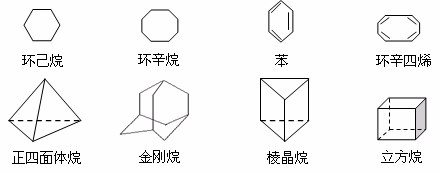
(1)互为同系物的有 和 (填名称,下同)。
互为同分异构体的有 和 . 和 (只要写二组即可)
(2)正四面体烷的二氯取代产物有 种;立方烷的二氯取代产物有 种;
金刚烷的一氯取代产物有 种。
(3)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例):
___________、 _________。
(4)立方烷的一种同分异构体属于芳香烃,该物质的结构简式______________________,
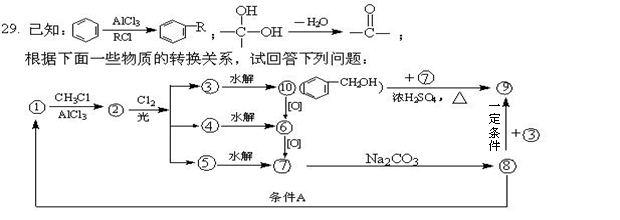 (1)化合物⑨的名称是_____________,反应条件A是________________________。
(1)化合物⑨的名称是_____________,反应条件A是________________________。
(2)写出有关反应的反应类型:
①→②:_________________________;⑩+⑦:____________________。
(3)写出下列反应的化学方程式:
⑧+③→⑨ __________________________________________________________。
④→⑥ _____________________________________________________________。
(4)已知CH3CH2OH有3种不同化学环境的H原子,则化合物⑨中有_______种不同化学环境的H原子。
(5)化合物⑦有多种含苯环的同分异构体,试写出两种与⑦不同类别的同分异构体的结构简式:
_________________________ 、___________________________。
七:计算题(16分)
27、某研究性学习小组对过量炭粉与氧化铜反应的气体产物成分进行研究。
⑴提出假设 ①该反应的气体产物是CO2。
②该反应的气体产物是CO。
③该反应的气体产物是_______________。
⑵设计方案 如图所示,将一定量的氧化铜在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
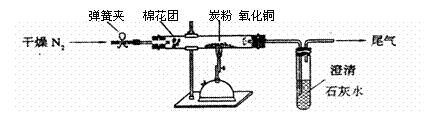
⑶查阅资料
氮气不与碳、氧化铜发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
请写出该反应的离子方程式: 。
⑷实验步骤
①按上图连接装置,并检查装置的气密性,称取4.80g氧化铜、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为53.84g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为 。
⑸数据处理
试根据实验数据分析,反应生成的气体是_____________;
写出该实验中氧化铜与碳发生反应的化学方程式:
。
⑹实验优化 学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是
。
②从环境保护的角度,请你再提出一个优化方案:
。
六:有机推断题(共20分)
26、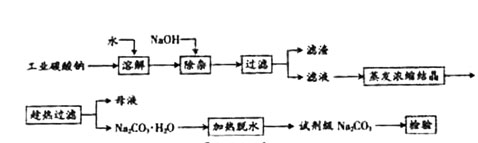 碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(钝度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(钝度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO 等杂质,提纯工艺路线如上:
等杂质,提纯工艺路线如上:
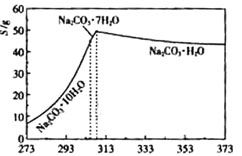 已知碳酸钠的溶解度(S)随温度变化的曲线如右图所示:
已知碳酸钠的溶解度(S)随温度变化的曲线如右图所示:
回答下列问题:
(1)滤渣的主要成分为 __________________
(2)“趁热过滤”的原因是 ________________。
(3)实验室进行“蒸发浓缩结晶”操作所需仪器除了酒精灯、铁架台外,还有_________、________。
(4)检验得到的试剂碳酸钠中是否含有SO 离子的操作是,取少量试剂于试管中配成溶液, _______________
离子的操作是,取少量试剂于试管中配成溶液, _______________
。
(5)若“母液”循环使用,可能出现的问题 ______________________。
(6)已知:
Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) -532.36 kJ
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) -473.63KJ
写出Na2CO3·H2O脱水反应的热化学方程式 __________________________。
25、煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
 (1)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)
①写出该可逆反应的化学平衡常数表达式_________________________________
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的
是 。 (填字母,下同)
a.容器中的压强不再改变 b. 1 mol H-H键断裂的同时断裂2molH-O键
c.v正(CO) = v逆(H2O) d. c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
 CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
|
H2O |
CO |
H2 |
CO |
|||
|
1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
|
2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
①实验1中以v(CO2) 表示的反应速率为 。
②该反应的逆反应为 (填“吸”或“放”)热反应
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
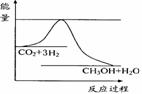 CO2(g)+3H2(g)
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量的变化。
CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量的变化。
在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使
c (CH3OH)增大的是________。
a.充入H2(g),使体系压强增大 b.降低温度
c.将H2O(g)从体系中分离出来 d.使用催化剂,加快反应
五:实验题(共24分)
24、某反应体系中的物质有:KIO3、KI、KBrO3、Br2、H2SO4、K2SO4和H2O。
(1)请将KIO3之外的反应物和生成物分别填入以下空格内:
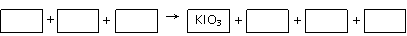
(2)其中被还原的元素是_________;氧化产物是______
(3)将氧化剂和还原剂及其配平后系数填入下列空格中,并标出电子转移的方向和数目
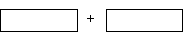
(4)已知在同样条件下,KIO3能和KI反应生成I2。若在酸性(硫酸)溶液中混合等物质的量的KBrO3和KI,则反应后的氧化产物为_____________。
23、A、B、M、X、Z是周期表中的短周期元素。对它们的单质或部分化合物描述如下:
|
A |
B |
M |
X |
Z |
|
最简氢化物是含氢量最高的有机物 |
单质为气体,元素原子中成对电子数比未成对电子数多一个 |
最简氢化物的水溶液呈酸性 |
原子核外有5种能量不同的电子,最外层有3个电子 |
最高价氧化物对应的水化物为最强酸 |
回答下列问题:
(1)B的最简氢化物的分子构型是 ____,A原子的最外层电子的轨道表示式为_______________;
(2)X在元素周期表中的位置为______周期____族,写出X的单质溶解在NaOH溶液中的
离子方程式为_______________________________;
(3)A、B两元素非金属性较强的是(写元素符号) 。写出证明这一结论的一个化学方程
式 ;
(4)与元素Z相比,元素M的最简氢化物稳定性 (选填“强”、“弱”),理由是____________________________________。
第Ⅱ卷(共84分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com