
题目列表(包括答案和解析)
11.用惰性电极电解2L硝酸银溶液,当在电路中通过0.1mol电子后,调换正负极,电路中又通过了0.2mol电子,此时溶液pH值为(假设溶液体积不变)是
A.2 B.3 C.1 D.无法确定
10.一种新型燃料电池,它是用两根惰性金属做电极插入KOH溶液中,然后向两极上分别通入甲烷和氧气,发生的电极反应为: X极:CH4+10OH-―8e-=CO32-+7H2O Y极:4H2O+2O2+8e-=8OH-
关于此燃料电池的下列说法中错误的是
A.X极为负极,Y极为正极
B.工作一段时间后,KOH的物质的量不变
C.在标准状况下通入5.6LO2完全反应,则有1.0mol电子发生转移
D.该电池工作时甲烷一极附近溶液的pH降低
9.用惰性电极电解一定质量的某浓度的NaCl溶液,一段时间后停止电解,此时若加入100g 36.5%的浓盐酸,所得溶液正好与原溶液完全相同,则下列说法正确的是
A.电解过程中,两极所得到的气体,在相同的条件下体积相等
B.电解过程中,在相同的条件下,阳极所得到的气体的体积比阴极的大
C.电解过程中转移电子的物质的量约为8mol
D.原某浓度的NaCl溶液中溶有117g NaCl
8.已知A+B=C+D为放热反应,对该反应的下列说法正确的是
A.A的能量一定高于C B.反应中A与B的总能量一定高于C与D的总能量
C.B的能量一定高于D D.因该反应是放热反应,故不加热该反应就能反应
7.根据以下四个反应:(1)H2S+I2=2H++2I-+S¯ (2)H2SO3+2H2S=3S¯+3H2O
(3)2I-+Br2=2Br-+I2 (4)H2SO3+I2+H2O=H2SO4+2HI
确定Br-、I-、H2S和H2SO3还原性由强到弱的顺序是
A.H2S>H2SO3>I->Br- B.Br->I->H2SO3>H2S
C.H2SO3>H2S>Br->I- D.I->Br->H2S>H2SO3
6.观察下列几个装置示意图,有关叙述正确的是
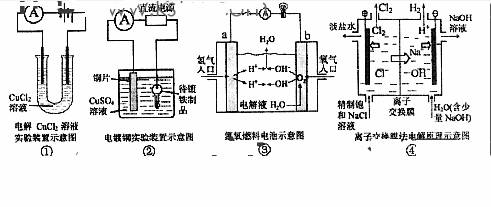
A.装置①中阳极上析出红色固体
B.装置②的待镀铁制品应与电源正极相连
C.装置③中闭合电键后外电路电子由a极流向b极
D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
21.(每空2分,共8分)
⑴_____________ ;
⑵_____________ ;
⑶__________ _,________________________ 。
20.(表格每空1分,其它每空2分,共12 分)
(1)______ ;_________ 。
(2)
|
实验方案 |
所选用试剂(填代号) |
实验现象 |
|
方案一 |
|
|
|
方案二 |
|
|
(3)
, 。
19.(每空2分,共8分)
(1) ;
(2) ;
(3) ;
(4) ;
18.(每空2分,共14分)
(1)
, ;
(2)
, ;
(3)
___ ;
(4)
,
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com