
题目列表(包括答案和解析)
11.常温下有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和Na2SO4溶液中的一种。已知A、B溶液中水的电离程度相同,A、C溶液的pH相同。下列说法中不正确的是( )
A.D溶液的pH=7
B.四种溶液相比,C溶液中水的电离程度最大
C.A与C等体积混合后,溶液中有c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.B与D等体积混合后,溶液中有c(OH-)=c(CH3COOH)+c(H+)
10.用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中正确的是( )
 A.电池工作时,正极反应式为:O2+2H2O+4e-===4OH- B.电解时,a电极周围首先放电的是Br-而不是
A.电池工作时,正极反应式为:O2+2H2O+4e-===4OH- B.电解时,a电极周围首先放电的是Br-而不是
Cl-,说明当其他条件相同时前者的还原性强于后者
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.b为负极,当电池中消耗0.02g H2时,b极周围会产生0.02g H2
9.下列实验装置设计正确,且能达到目的的是( )

8. 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中不正确的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中不正确的是( )
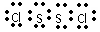
A.S2Cl2的电子式为 ,是极性分子
B.S2Cl2分子中既有极性键又有非极性键
C.S2Br2与S2Cl2结构相似,熔点S2Br2<S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O===SO2↑+3S↓+4HCl
7.NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A.35.5g超氧化钾(KO2)所含的阴离子中电子数为8NA
B.标准状况下,11.2L氯仿中含有的C-Cl键的数目为1.5NA
C.常温常压下,92gNO2和NO4混合气体中含有的原子数为6NA
D.工业上电解精炼铜时电解池中每转移1mol电子,阳极上溶解的铜原子数为0.5NA
6.下列说法正确的是( )
A.天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源
B.液氨、石墨和水分别属于非电解质、强电解质和弱电解质
C.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
D.纯碱、硝酸、硬脂酸钠和干冰分别属于碱、酸、盐和氧化物
30.(15分)已知A、B、C、D、E、F六种有机物存在如下转化关系, E在核磁共振氢谱中出现三组峰,其峰面积之比为6:1:1,F能使Br2的CCl4溶液褪色。回答下列问题:
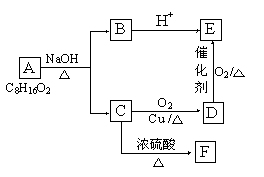
(1)C和E的官能团名称:C ,E ;
(2)由F生成高聚物的化学方程式
(3)六种有机物中能跟Na反应的是 (填字母)
(4)由A生成B和C的化学反应方程式为
(5)D在一定条件下生成C的化学反应方程式为
29.(15分)某校化学小组学生利用下图所列装置进行 “铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)

(1)装置B中发生反应的化学方程式是
(2)装置E中的现象是:
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中 Fe3+的操作方法:
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:

① 步骤I中通入Cl2的作用是
② 该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
28.(16分)为探究铜跟浓硫酸的反应情况,用下图所示装置进行有关实验。请回答:

(1)装置A中发生的化学反应方程式为_____________________________________。
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是_____________,其作用是(用离子方程式表示)_________________________ 。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是 。
B中应放置的液体是(填字母)__________________。
a.水 b.酸性KMnO4 溶液 c.NaOH溶液 d.饱和NaHSO3溶液
(4)装置C和D中产生的现象相同,但原因却不同。C中是由于 ,而D中则是由于 。
(5)实验中,取一定质量的铜片和一定体积18 mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是
。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是________(填字母)。
a.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
27.(12分)根据下图所示的关系填空,已知A为FeS2固体,C的焰色反应火焰呈黄色,其中①、③是硫酸工业生产中的重要反应,D、E常温下为气体,X常温下为无色液体,F是红棕色固体。

(1)物质X的化学式是 ____ 。
(2)化合物B中所包含的化学键有 和 __ 。
(3)反应④的离子方程式为 。
反应②的化学方程式为___ ___,其中还原剂是 。
(4)已知每生成16克E,放出106.5KJ的热量,则反应①的热化学反应方程式为 ___ 。(相对原子质量:Fe-56 S-32 O-16)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com