
题目列表(包括答案和解析)
6. 有关晶体的下列说法正确的是
A.干冰属于分子晶体,其晶体中存在氢键
B.在晶体中,只要有阴离子就一定有阳离子
C.不含任何化学键的晶体是不存在的
D.分子晶体的熔点一定低于金属晶体
5. 工业上用二氧化锰制备高锰酸钾可分两步进行。
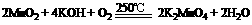 (1) 二氧化锰与氢氧化钾共熔,并通入氧气:
;
(1) 二氧化锰与氢氧化钾共熔,并通入氧气:
;
(2) 电解锰酸钾溶液: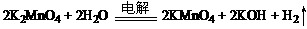 。
。
下列说法正确的是
A.上述物质中,氧化性:KMnO4> K2MnO4 >O2
B.上述过程中,每生成1 mol KMnO4需转移6 mol 电子
C.电解时,KMnO4在阳极区生成
D.电解时,阴极周围pH减小
4. 下列说法正确的是
A.测定中和热时,所用稀NaOH溶液和HCl的物质的量恰好相等,以减小实验误差
B.NaHSO4固体受热变为熔融状态(未发生化学反应),需要克服的作用力有:离子键和共价键
C.在Fe(OH)3胶体中通电,一段时间后,阴极附近颜色加深
D.用蒸馏的方法分离淀粉溶液与Cu(OH)2悬浊液的混合物
3. 下列热化学方程式或离子方程式中,正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g) + 2O2(g) = CO2(g) + 2H2O(g);△H = – 890.3kJ·mol-1
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:
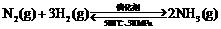 ;△H = – 38.6 kJ·mol-1
;△H = – 38.6 kJ·mol-1
C.氯化镁溶液与氨水反应:
D.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+=Cu2+ + 2Fe2+
2. 下列说法正确的是
A.测定硫酸铜晶体中结晶水含量时,应先用称量纸称量一定质量的硫酸铜晶体,再将其转入到坩埚中加热
B.NH4+、Ag+、PO43-、Cl-能在溶液中大量共存
C.1 L 1 mol·L-1的碳酸钠溶液吸收SO2的量大于1 L 1mol·L-1硫化钠溶液吸收SO2的量
D.相同条件下,2 mol氢原子所具有的能量大于1 mol氢分子所具有的能量
1. 下列鉴别方法不可行的是
A.只用水就可以鉴别乙醇、溴乙烷与乙酸乙酯
B.用Ba(NO3)2溶液鉴别SO32-、SO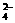 和CO
和CO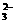
C.用氨水可鉴别Al3+和Ag+
D.用KMnO4酸性溶液鉴别苯和甲苯
21、(12分)某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。

请回答下列问题:
(1)硬质试管中发生反应的化学方程式为____________________________ 。
(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中所含固体物质的成分有: 种(填1种、2种、1种或2种),具体情况是 ,若溶液未变红色则说明硬质试管中固体物质的成分有: 种(填1种、2种、1种或2种),具体情况是 。
(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是: (用离子方程式表示)。
 (4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按右图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式:
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按右图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式:
。
20.(12分) A、B、C、D、E、X、Y为中学常见的七种物质,它们有如下转化关系(部分产物与反应条件略去):

(1)若A为金属单质,B为氢气,X为盐酸,Y为强碱溶。则A物质的名称是 ;D与Y反应的离子方程式为 ;
(2)若A、C为同主族元素组成的单质,通常状况下,A为气体,C为液体,Y为金属单质。则A→C的反应类型是 ;将X通入A的溶液中,可观察到的现象是 ;C→D的化学反应方程式为 。
(3)若A、C为为短周期不同主族元素组成的单质,通常状况下,A、C均为固体,X、Y为气体。则A→C的反应方程式是 ;该反应发生时盛有X的装置 (填是、否)需要做什么处理中,如需要怎么处理 (如不需要此问不需作答)。为什么: 。
19、(14分)X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题: ⑴ L的元素符号为________ ; M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。 ⑵ Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。 ⑶硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,原子结构示意图为: 其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。 a.+99.7 mol·L-1 b.+29.7 mol·L- 1 c.-20.6 mol·L-1 d.-241.8 kJ·mol-1 ⑷用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式:____________________;
由R生成Q的化学方程式:__________________________;
18、(10分)由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、SO42-、CO32-。将该混合物溶于水后得澄清溶液.现取3份l00mL该溶液分别进行如下实验:
|
试验序号 |
试验内容 |
试验结果 |
|
1 |
加AgNO3溶液 |
有白色沉淀生成 |
|
2 |
加足量NaOH溶液并加热 |
收集到气体 1.12L(已折算成标准状况下的体积) |
|
3 |
加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为 6.27g,第二次称量读数为 2.33g |
试回答下列问题: (1)根据实验1对Cl-是否存在的判断是 (填“一定存在”、“一定不存在”或“不能确定”);根据实验l-3判断混合物中一定不存在的离子是 。 (2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
|
阴离子符号 |
物质的量浓度(mo1·L-) |
|
|
|
|
|
|
(3)试确定K+是否存在? ,判断的理由是 .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com