
题目列表(包括答案和解析)
7、下列物质的分类中,前者是电解质,后者是非电解质的组合是
A、空气、Cl2 B、NaHCO3、蔗糖
C 、Ba(OH)2、CH3CH2OH D、H2SO4、盐酸
6、某同学欲配制含有大量下列各离子的溶液,其中能实现的是
A、K+、H+、SO42-、OH- B、Na+、Ca2+、CO32-、NO3-
C、Na+、H+、Cl-、HCO32- D、Na+、Cu2+、Cl-、SO42-
5.科学家指出,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的+5价砷类物质在维生素C的作用下,能够转化为有毒的+3价砷类化合物.下列说法不正确的是
A.维生素C具有还原性
B.上述过程中砷元素发生还原反应
C.上述过程中+5价砷类物质作氧化剂
D.+5价砷转化为+3价砷时,失去电子
4.在下列化学方程式中,能够用离子方程式Ba2++SO42-=BaSO4↓表示的是
A.BaCl2+K2SO4=BaSO4↓+2KCl
B.BaCO3+H2SO4 = BaSO4↓+CO2↑+H2O
C.Ba(OH)2+ H2SO4= BaSO4↓+2H2O
D.Ba(OH)2+ 2KHSO4 = BaSO4↓+K2SO4+2H2O
3.下列属于氧化还原反应的是
A.CaCO3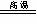 CaO+CO2↑
CaO+CO2↑
B.Na2O+H2O=2NaOH
C.Na2CO3+H2SO4=.Na2SO4+CO2↑+H2O
D.MnO2+4HCl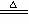 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
2、经分析可知某物质中含有两种元素,此物质不可能是
A、化合物 B、单质 C、混合物 D、纯净物
1、根据广州中心气象台报道,近年来,我省沿海一些城市春季多次出现大雾天气,致使高速公路关闭,航班停飞。雾属于下列分散系中的
A、溶液 B、悬浊液 C、乳浊液 D、胶体
21.铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。 “速力菲”是市场上一种常见的补铁药物,下表格是它的说明书。
|
[规格] 每片含琥珀酸亚铁0.1g [适应症] 用于缺铁性贫血症,预防及治疗用。 [用量用法] 成人预防量0.1g/日,成人治疗量0.2g-0.4g/日, 小儿用量预防量30-60mg/日,治疗量0.1g-0.3g/日。 [儲藏] 避光、密封、在干燥处保存 |
该药品中Fe2+ 会缓慢氧化,国家规定该药物中Fe2+ 的氧化率超过10%即不能再服用。
①(2分)为了检验某药店出售的“速力菲”是否氧化,实验室可选用最常用最灵敏的检验试剂为 ___________ ( 填试剂的名称 )
②(3分)实验室采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+ 进行滴定(假设药品中,其它成分不与KMnO4反应)。请配平下列离子方程式
______MnO4- + ______Fe2+ + ______H+ == ______Mn2+ + ______Fe3+ + ______H2O
③(5分) 称量上述含铁元素质量分数为20.00% 的“速力菲”10.00 g,将其全部溶于稀硫酸中,配制成1000.00 mL溶液,取出20.00 mL,用0.01 mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00 mL。该药品可以服用吗?______________(填“可以”或“不可以”),请通过计算简述理由(写出主要计算过程)
临湘一中2011届高三第三次阶段性质量检测
20.二氧化锰(MnO2)与浓盐酸混合加热可得到氯气,下图是制取并探究Cl2化学性质的装置图。
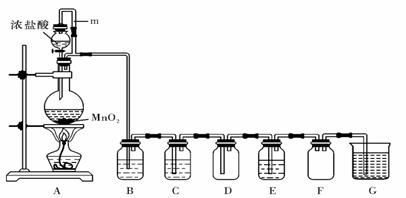
(1)圆底烧瓶中发生反应的化学方程式为 。
(2)E中若装有FeCl2 溶液,反应的离子方程式为 ;
F的作用是 。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是 。
(4) 能使湿润的淀粉-KI试纸变蓝的气体是 。
(a) Cl2 (b) N2O4 (c) I2蒸气 (d) SO2 (e) O3 (f) CO2
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象,临湘一中高三化学兴趣小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体,加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2 中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是 ;
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是 。
19.双氧水(H2O2)是一种极弱电解质,也是一种“绿色氧化剂”。为了贮存、运输的方便,工业上将其转化为固态过碳酸钠(2Na2CO4·3H2O2),该物质具有Na2CO3与H2O2的双重性质。请回答下列问题:
(1)写出H2O2的电子式: ,并写出它与SO2反应的化学方程式 。
(2)若把H2O2看成二元弱酸,写出它在水中第一步电离的方程式 。
(3)下列物质不会使过碳酸钠失效的是
A.MnO2 B.NaHCO3 C.H2S D.CH3COOH
(4)H2O2成为“绿色氧化剂”的理由是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com