
题目列表(包括答案和解析)
26.(18分)用如下装置可以完成一系列实验(图中夹持装置已略去)。
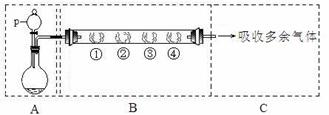
请回答下列问题:
Ⅰ.若装置A中选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中设计实验,请填写表中空白:
|
B中棉花的位置 |
① |
② |
③ |
④ |
|
所蘸试剂 |
石蕊试液 |
品红溶液 |
淀粉和碘水混合液 |
氢硫酸 |
|
现象 |
|
|
褪色 |
浅黄色 |
|
体现SO2的性质 |
水溶液显酸性 |
漂白性 |
|
氧化性 |
II.若装置A中选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液。请回答下列问题:
(1)写出用浓硫酸和浓盐酸混合制取HCl气体时,有利于HCl气体逸出的原因(写出两点) , 。
(2)反应开始后,观察到②处棉花变成棕黄色,则①处包有的某固体物质可能是 。a.KMnO4 b.KCl c.Cu
写出②处发生反应的离子方程式 。
(3)在实验过程中,在③处能观察到 。
(4)反应较长时间后,②处的棕黄色褪去,产物之一为HIO3(强酸),写出该反应的离子方程式: 。k*s*5*u
25.(12分)已知NaBH4是一种强还原剂,其中B元素处于最高价态。解决下列问题:
(1)在60年代,德国拜尔药厂用下面的反应把NaBH4的生产发展成工业规模。请将下列反应方程式配平,各物质的计量数填入相应空格中:
1 Na2B4O7+ Na+ H2+ SiO2= NaBH4+ Na2SiO3
(2)NaBH4极易溶于水并与水反应产生H2,反应后硼以BO2-形式存在,则NaBH4与水反应的离子方程式为___________ ____;如果反应中转移2mol电子,则可生成标准状况下的H2为 L;
(3)在碱性条件下NaBH4不与水反应放出氢气,但可使许多金属离子还原成单质,反应后硼仍以BO2-形式存在。在冶金工业中,常用NaBH4处理含Au3+的碱性废液。如要处理800kg含Au3+ 0.197%的废液,则理论上需NaBH4的质量___________g。k*s*5*u
13.某学生欲配制1.0mol/LNaOH溶液1L,配制时下列操作可能会造成溶液的实际浓度偏高的是( )
A.所使用的NaOH已在空气中部分变质
B.将NaOH溶解,并将溶液转移入1000mL容量瓶后,“定容”时,俯视容量瓶刻度线
C.把烧碱放在纸片上称量
D.天平空盘时,指针指向刻度盘“0”刻度的左边,称量达平衡时,指针指在“0”
12.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有( )
A.滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3-
B.pH为13的溶液:CO32-、SO32-、S2O32-、Na+
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
D.能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、Br-
11.设NA代表阿佛加德罗常数,下列说法错误的是( )
A.12g C60中含有6NA个电子
B.1mol HNO3见光分解,转移电子数4NA
C.46g NO2和46g N2O4含有的原子数均为3NAk*s*5*u
D.60g SiO2与足量纯碱反应,高温下最多可释放出NA个气体分子
10.将amol钠和amol铝一同放入mg水(足量)中,所得溶液的密度为dg/mL,下列说法正确的是( )
A.该溶液的物质的量浓度: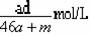 B.所得气体体积一定为44.8aL
B.所得气体体积一定为44.8aL
C.该溶液的质量分数: 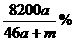
D.向溶液中通入过量CO2,未见白色沉淀
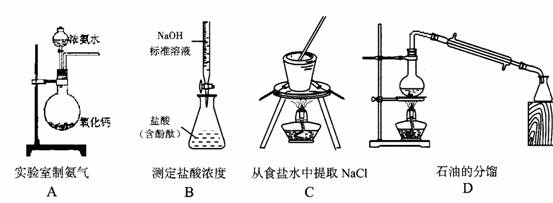
9.下列实验装置正确的是( )
8.下列物质:①稀硝酸 ②铁粉 ③碘化钾溶液 ④氢氧化钠溶液 ⑤硫氰化钾溶液 ⑥酸性高锰酸钾溶液,与硫酸铁不反应的是( )
A.①⑥ B.④⑥ C.③④ D.①④⑥
7.下列说法正确的是( )
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C.Mg、Al、Cu可以分别用热还原法、直接加热分解法和电解法冶炼得到
D.氢氧化铁胶体的制备:将氯化铁溶液滴加到热的浓氢氧化钠溶液中并不断搅拌
27.三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是 。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? 简述你的理由(不需写出反应的方程式 )
。
(3)若固体粉末完全溶解无固体存在 , 滴加 KSCN 试剂时溶液不变红色 , 则证明原固体粉末是 ,写出发生反应的离子方程式 、
、 。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4) 实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com