
题目列表(包括答案和解析)
5.下列实验中金属或氧化物可以完全溶解的是( )
A.0.1 mol铜片与含0.2 mol H2SO4的浓硫酸共热
B.0.1 mol MnO2粉末与含0.2 mol H2O2的溶液共热
C.常温下0.1mol铝片投入足量的浓硫酸中
D.常温下0.1mol铜片投入含0.4 mol HNO3的浓硝酸中
4.被誉为“太空金属”的钛,在室温下不与水、稀盐酸、稀硫酸和稀硝酸等作用,但易溶于氢氟酸,你认为其原因可能是 ( )
A.氢氟酸的酸性比其他酸强 B.氢氟酸的氧化性比其他酸强
C.氢氟酸的还原性比其他酸强 D.钛离子易与氟离子形成可溶性难电离物质
3.近年来食品安全问题已越来越引起社会方法关注,下列食品的加工方法你认为比较安全的是( )
A.在辣椒面中添加苏丹红,使其颜色鲜红
B.在加工米线过程中使用吊白块增白
C.在清洗蔬菜时,加入臭氧降解新鲜蔬菜表面残留的农药
D.用二氧化硫气体漂白发黄的竹笋
2.水是生命之源,下列有关说法中正确的是( )
A.双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境没有污染
B.王水是浓盐酸和浓硝酸按体积比1:3配成的混合物,可以溶解Au、Pt
C.氨水能导电,说明氨气是电解质
D.新制备的氯水中存在三种分子,四种离子
1.充分利用能源、提高原子利用率、减少向环境排放废弃物等都是“绿色化学”的基本要求。① 实验室短时间保存硫酸亚铁溶液时,向试剂瓶中添加少量铁粉和稀硫酸; ② 用稀硝酸代替浓硝酸溶解、回收做银镜实验后试管内壁的银; ③接触法制硫酸的设备中安装“热交换器”,利用余热预热冷原料气; ④工业合成氨中分离产物得到氢气和氮气再循环使用。上述主要从“绿色化学”角度考虑的是( )
A.①② B.②④ C.②③④ D.①③④
23.(10分)在25℃、101 kPa条件下,将15 L O2通入10 L CO和H2的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
⑴若剩余气体的体积是15 L,其中O2占 L,则原CO和H2的混合气体中
V(CO)= L,V(H2)= L。
⑵若剩余气体的体积为a L,则原CO和H2的混合气体中V(CO):V(H2) = 。
⑶若剩余气体的体积为a L,则a的取值范围是 。
22.(10分)钠是一种很活泼的金属,在工业上常用电解熔融NaCl的方法制得,其另一产物氯气的用途也十分广泛,工业上制取漂白粉就是其用途之一。
(1)请写出工业上用电解方法制取钠的化学方程式 。
(2)工业上制取漂白粉的化学反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉的主要成分是 、 。
(3)实验室有一瓶密封不严的漂白粉,其中肯定存在CaCl2,请设计实验,探究该固体中可能存在的其它物质。
①提出合理假设。
假设1:该漂白粉未变质,只含 ;
假设2:该漂白粉全部变质,只含 ;
假设3:该漂白粉部分变质,既含有Ca(ClO)2又含有CaCO3。
② 设计实验方案,进行实验。请在答题卡上写出实验步骤、预期现象与结论
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、1mol/LHCl、品红溶液、新制澄清石灰水。(提示:不必检验Ca2+和Cl-,表格可以不填满。)
|
实验步骤 |
预期现象和结论 |
|
|
① |
取少量上述漂白粉于试管中, |
|
|
② |
|
|
|
③ |
|
|
21.(8分)将浓度为C1的浓硫酸50g(溶质的质量分数为w1)与VmL水混合,得到物质的量浓度为C2的稀硫酸(溶质的质量分数为w2)(以下填“>”、“<”或“=”)
⑴若w1=2w2,则C1 2C2,V 50mL。
⑵若C1 =2C2,则w1 2w2, V 50mL。
20.(8分)已知氧化性BrO3―> ClO3―>Cl2>IO3―>I2。现将饱和氯水逐滴滴入KI淀粉溶液中至过量。
⑴可观察到的现象是: ① ;② 。
⑵写出有关离子方程式:① ;
② 。
19.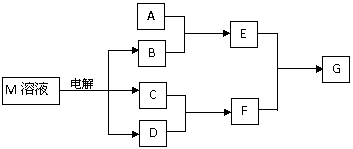 (10分)已知物质M由X、Y两种短周期元素且同周期元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的最低负价代数和为6。M与其它物质的转化关系如下(部分产物已略去)
(10分)已知物质M由X、Y两种短周期元素且同周期元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的最低负价代数和为6。M与其它物质的转化关系如下(部分产物已略去)
(1)若A是X、Y同周期元素的一种单质,当F的水溶液过量时,G为可溶性盐,当F的水溶液不足时,G为沉淀,则E与过量F溶液反应的离子方程式是 。
(2)若A是一种常见酸性氧化物,且可用于制造玻璃,则A与B反应的化学方程式是 。
(3)若A是一种常见化肥,其水溶液呈酸性,且E与F反应生成G时有白烟产生,则溶液中A与B加热时反应的离子方程式是 。
 (4)若A是一种溶液,只可能含有H+、NH4+、
(4)若A是一种溶液,只可能含有H+、NH4+、
Mg2+、Fe3+、A13+、CO32-、SO42-中的某些
离子,当向该溶液中加入B溶液时,发现
生成沉淀的物质的量随B溶液的体积变化
如图所示,由此可知,该溶液中肯定含有
的阳离子是 ,且各阳离子的物质的量之比为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com