
题目列表(包括答案和解析)
4.如下图装置,将溶液A逐滴加入固体B中,下列叙述正确的是 ( )
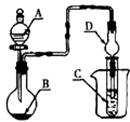 A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C.若A为浓氨水,B为生石灰,C中盛A1C13溶液,则C中先产生白色沉淀,后沉淀又溶解
D.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
3.被誉为“光纤之父”的华人科学家高锟荣获2009年诺贝尔化学奖。下列叙述不正确的是( ) A.SiO2是生产光导纤维和粗硅的主要原料 B.SiO2与CO2都属于酸性氧化物,都不能与酸反应 C.SiO2与CO2(干冰)的晶体结构不同 D.水晶的主要成分是SiO2
2.下列叙述中,正确的是 ( )
A.某溶液加四氯化碳后,振荡静置,CCl4层呈现紫色,证明原溶液中存在I- B.凡能使湿润的淀粉KI试纸变蓝的物质一定是Cl2 C.某溶液中加入BaCl2溶液,产生不溶于稀HNO3的白色沉淀,原溶液一定含有Ag+ D.氢氟酸是弱酸,但会腐蚀玻璃
1.Cu、Fe混合物与稀HNO3完全反应后剩余固体为Cu,反应后的溶液中一定有 ( )
A.Fe3+ B.Fe2+ C.Cu2+ D.Fe3+、Fe2+、Cu2+
21.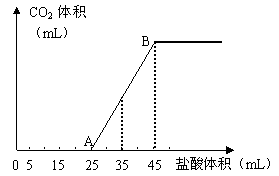 将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合
将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合
物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加
入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的
体积(标准状况)关系如下图所示:
(1)写出OA段所发生反应的离子方程式
_________________ 。
(2)当加入35mL盐酸时,产生CO2的体积
为___________mL(标准状况)。
20. A、B、C、D为四种单质,常温时,A、B是气体,C、D是固体。E、F、G、H、I为五种化合物,F不溶水,E为气体且极易溶水成为无色溶液,G溶于水得黄棕色溶液。这九种物质间反应的转化关系如图所示
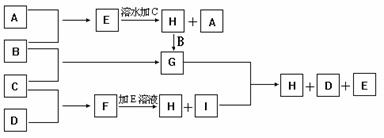
(1)写出D单质的化学式_____________.
(2)写出E+F→H+I的离子方程式_______________.
19.甲醇被称为2l世纪的新型燃料,工业上通过下列
反应①和②,用CH4和H2O为原料来制备甲醇。
①
CH4(g)+H2O(g)  CO(g)+3H2(g) △H1
CO(g)+3H2(g) △H1
② CO(g)+2H2(g)
 CH3OH(g) △H2
CH3OH(g) △H2
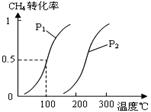
将0.20mol CH4和0.30 mol H2O(g)通入容积为10L的密闭
容器中,在一定条件下发生反应①,达到平衡时,CH4的
转化率与温度、压强的关系如右图。
(1)温度不变,缩小体积,增大压强,①的反应速率
(填“增大”、“减小”或“不变”),平衡向 方向移动。
(2)反应①的△H1 0(填“<”、“=”或“>”),其平衡常数表达式为K= ,100℃时的平衡常数值是 。
(3)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下进行反应②生成甲醇。为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表空格中填入剩余的实验条件数据。
|
实验编号 |
T(℃) |
n (CO)/n(H2) |
P(MPa) |
|
I |
150 |
1/3 |
0.1 |
|
II |
|
|
5 |
|
III |
350 |
|
5 |
18.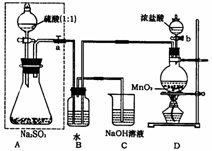 长期存放的亚硫酸钠可能会被空气中的氧气氧化。某化学兴趣小组通过实验来测定亚硫酸钠试剂的被氧化的程度,设计了右图实验:请回答下面的问题:
长期存放的亚硫酸钠可能会被空气中的氧气氧化。某化学兴趣小组通过实验来测定亚硫酸钠试剂的被氧化的程度,设计了右图实验:请回答下面的问题:
(1)D装置中反应的化学方程式为_________________________.
B装置中反应的离子方程为:_________________________。
(2)称量ag Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应,过滤、洗涤、干燥,得白色沉淀bg,原样品中Na2SO3的质量分为数为:_________________。
(3)为保证实验测定的准确性,则C装置中反应的离子方程式为: ___________________________________________ 。
 (4)现有以下试剂:①蒸馏水、②稀盐酸、③稀硝酸、④BaCl2溶液、⑤Ba(NO3) 2溶液,请从中选择合适试剂,设计一种不同的实验方法测定试样中无水亚硫酸钠被氧化的程度 ,你使用试剂的顺序为:__________________.(填试剂编号)
(4)现有以下试剂:①蒸馏水、②稀盐酸、③稀硝酸、④BaCl2溶液、⑤Ba(NO3) 2溶液,请从中选择合适试剂,设计一种不同的实验方法测定试样中无水亚硫酸钠被氧化的程度 ,你使用试剂的顺序为:__________________.(填试剂编号)
17. 氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e-=NO+2H2O ;
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的化学方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)KMnO4在酸性溶液中发生还原反应的反应式: 。
16. A、B、C、D、E是位于短周期的主族元素,其中A、B为金属元素,D的最外层电子数是其内层电子数的三倍。已知:①热稳定性:HmD>HmC;② 、
、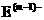 具有相同的电子层结构;③B与E在同一周期,在该周期中,E的原子半径最小,B的离子半径最小;④A、B所形成的单核离子具有相同的电子层结构,B的最高价氧化物对应的水化物与A、E的最高价氧化物对应的水化物都能反应。依据上述信息用化学用语回答下列问题:
具有相同的电子层结构;③B与E在同一周期,在该周期中,E的原子半径最小,B的离子半径最小;④A、B所形成的单核离子具有相同的电子层结构,B的最高价氧化物对应的水化物与A、E的最高价氧化物对应的水化物都能反应。依据上述信息用化学用语回答下列问题:
(1)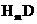 的电子式_______________ 。
的电子式_______________ 。
(2) 、
、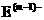 的还原性强弱为 ______ > _________ ,能证明其还原性强弱的离子方程式为
_______________。
的还原性强弱为 ______ > _________ ,能证明其还原性强弱的离子方程式为
_______________。
(3)写出B的最高价氧化物对应的水化物和A的最高价氧化物对应的水化物反应的离子方程式 ___________________________________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com