
题目列表(包括答案和解析)
10、下列说法正确的是 ( )
A.pH=7的CH3COOH 和CH3COONa混合溶液中,c(CH3COO-)> c(Na+)
B.0.1 mol/L的CH3COONa溶液中:c(CH3COO-)+ c(CH3COOH) = 0.1mol / L
C.将pH = 4的醋酸溶液稀释,溶液中所有阴、阳离子的物质的量浓度均降低
D.pH=12的氨水溶液与pH=2的盐酸等体积混合后:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
9.下列实验设计能完成或实验结论合理的是 ( )
A.证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾-淀粉试纸检验,观察试纸颜色的变化
B.某溶液中加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,说明该溶液中有Ca2+
C.测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
D.用核磁共振氢谱图鉴别乙醇和乙酸
8、下列描述违背化学原理的是 ( )
A.NaHCO3溶液与NaAlO2溶液混合产生白色沉淀,说明酸性:HCO3->Al(OH)3
B.将SO2通入酸性高锰酸钾溶液中,溶液褪色,说明SO2具有漂白性
C.浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成有色产物能溶于浓硝酸
D.在氯化银中加入KI溶液,一段时间后沉淀变成黄色,说明同温度下Ksp(AgI)< Ksp(AgCl)
7、设NA 代表阿伏加德罗常数的数值,下列说法中正确的是 ( )
①常温常压下,17g 甲基(-14CH3)所含的中子数为9NA
②常温常压22.4L NO气体的分子数小于NA
③ 64g的铜发生氧化还原反应,一定失去2NA个电子
④常温常压下,100mL 0.5mol·L-1的HF溶液中,HF分子数目小于0.05NA
⑤标况时,22.4L二氯甲烷所含有的分子数为NA
⑥常温常压下,1 mol氦气含有的核外电子数为 4NA
A.①② B.③④ C.②④ D.⑤⑥
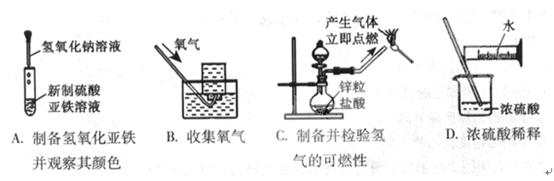
6、下列实验能达到实验目的且符合安全要求的是( )

5、已知:H2O(g)=H2O(l) △H1=-Q1 kJ/mol;
C2H5OH(g)=C2H5OH(l) △H2=-Q2 kJ/mol;
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3 kJ/mol。
则酒精的燃烧热△H为 ( )
A.-2(Q1+Q2+Q3)kJ/mol B.-(Q1+Q2+Q3 ) kJ/mol
C.-(Q1-Q2+Q3 ) kJ/mol D.-(3Q1-Q2+Q3 ) kJ/mol
4、下列是某学生自己总结的一些规律,其中正确的是 ( )
A.氧化物不可能是还原产物,只可能是氧化产物
B.有些化学反应不属于化合、分解、置换、复分解中的任何一种反应
C.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
D.饱和溶液一定比不饱和溶液的浓度大
3、在下列溶液中,一定能够大量共存的离子组是 ( )
A.无色溶液:Fe2+ 、SO42-、NO3-、Na+
B.pH=1的溶液:Ca2+ 、Na+ 、Mg2+ 、NO3-
C.使石蕊显红色的溶液:Fe3+ 、NH4+ 、C1-、SCN-
D.水电离出的c(H+ )=l0-14 mo1/L的溶液:ClO-、Cl-、Na+ 、Cu2+
2、下列判断错误的是 ( )
A. 离子半径:Cl- > Al3+ B. 热稳定性:HBr >HI
C. 与水反应的速率:Cs> Ca D.结合H+的能力:C6H5O- > CO32-
1、下列说法中,正确的是 ( )
( )
A. 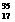 Cl和
Cl和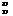 Cl属于同种核素
Cl属于同种核素
B. 只由一种元素组成的物质一定为纯净物
C. 46 g NO2和46 g N2O4 含有的原子数相等
D. 0.5 mol乙酸中含有的共价键数约为8×6.02×1023
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com