
题目列表(包括答案和解析)
5.如图为一种钮扣微型电池,其电极分别为Ag2O和Zn电解质溶液是KOH溶液,俗称银锌电池,该电池的电极反应式为:Zn +Ag2O== ZnO+2Ag根据以上提供的资料,下列说法正确的是
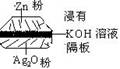 A.溶液中OH-向正极移动
A.溶液中OH-向正极移动
B.放电时正极附近溶液的PH值升高;
C.电池负极的电极反应为:Zn - 2e- = Zn2+
D.电池工作时,生成1molAg就有2mol电子转移
4.下列说法不正确的是
① C2H6分子中既含极性键又含非极性键
② 若R2-和M+的电子层结构相同,则原子序数:R>M
③ F2、Cl2、Br2、I2熔点随相对分子质量增大而升高
④ NCl3、PCl3、CO2、CS2分子中各原子均达到8e-稳定结构
⑤ 若X的质子数为a,中子数为b,则原子可表示为abX
⑥ 由于非金属性Cl>Br>I,所以酸性HCl>HBr>HI
⑦ 由于氨和水分子之间能形成氢键,NH3分子极易溶于水
⑧ 原子序数为34号的元素属于长周期的副族元素
A.②⑤⑥⑧ B.①③④⑤ C.②④⑤⑦ D.③⑤⑦⑧
3.若NA表示阿伏伽德罗常数,下列叙述中正确的是
A.1mol含8个碳原子的某烃分子,最多形成8mol碳碳单键
B.16.9 g 过氧化钡(BaO2)固体中阴、阳离子总数为0.2NA
C.1 mol Cl2发生反应时,转移的电子数一定是2NA
D.精炼铜过程中阳极减轻6.4g时,电路中转移电子数一定是0.2NA
2.下列各组物质充分反应后,加热蒸干并在300℃灼烧至固体质量不变,最终残留固体为纯净物的是
A.在溴化钠和碘化钾的混合溶液中通入过量的氯气
|
C.向硫酸亚铁溶液中加入适量的氢氧化钠溶液至不再产生沉淀
D.等物质的量浓度、等体积的硫酸铵与氯化钡溶液相混合
1.2010年上海世博会的主题是“城市,让生活更美好”。下列叙述中不正确的是
A.世博会前期,处理废水时加入明矾可作为混凝剂以吸附水中的杂质
B.世博会期间,利用可降解的“玉米塑料”替代一次性饭盒,可防止产生白色污染
C.世博会中国馆--“东方之冠”使用的钢筋混凝土属于高分子化合物
D.世博停车场安装催化光解设施,可将汽车尾气中CO和NOX反应生成无毒气体
30.(B)生态溶液涉及农家肥料的综合利用,某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体。2.016L标准状况下的该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管中物质的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水,充分吸收,生成沉淀8.5g。
CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管中物质的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水,充分吸收,生成沉淀8.5g。
(1) 试计算原混合气体中甲烷的物质的量。
(2) 原混合气体中氮气的体积分数为多少?
黄浦区2010学年度第一学期高三化学期终测试题
30.(A)使一定量的磷化氢和氢气的混合气体,依次通过两支加热的硬质玻璃管,第1支玻璃管中装有铜屑,第2支玻璃管中装有氧化铜,第1支玻璃管中由于发生如下反应:2PH3+Cu Cu3P2(s)+3H2,玻璃管中物质的质量增加4.96 g,第2支玻璃管中物质的质量减少了5.76 g。
Cu3P2(s)+3H2,玻璃管中物质的质量增加4.96 g,第2支玻璃管中物质的质量减少了5.76 g。
(1)计算原混合气体中磷化氢和氢气的体积比。
(2)在标准状况下,原混合气体的密度是多少?
29.(B)海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
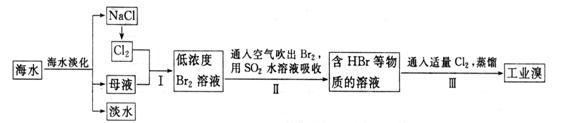
(1)请列举海水淡化的一种方法: 。
(2)将NaCl溶液电解,在电解槽中可直接得到的产品H2、 、 ,或H2、 。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为 _________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了解到如下装置:
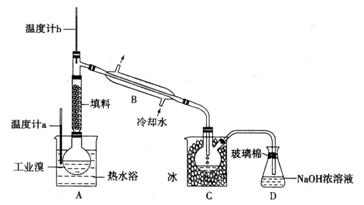
请你参与分析讨论:
① 图中仪器B的名称: 。
② 整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是__________________
。
③ 实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
。
④ C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
29.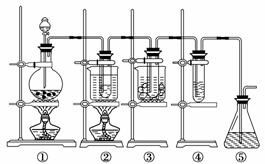 (A)实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
(A)实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过 (填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有 (填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
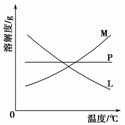 (2) 比较制取氯酸钾和次氯酸钠的条件,二者的差异是:
(2) 比较制取氯酸钾和次氯酸钠的条件,二者的差异是:
反应完毕经冷却后,②的试管中有大量晶体析出。
右图中符合该晶体溶解度曲线的是
(填写编号字母);冷却后从②的试管中分离出该晶体的方法是 (填写实验操作名称)。
(3)本实验中制取次氯酸钠的离子方程式是 ,实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
|
实验现象 |
原因 |
|
溶液最初从紫色逐渐变为 色 |
氯气与水反应生成的H+使石蕊变色 |
|
随后溶液逐渐变为无色 |
|
|
然后溶液从无色逐渐变为 色 |
|
28.某化学实验兴趣小组为探究实验室制备Cl2 的过程中有水蒸气和HCl挥发来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略):
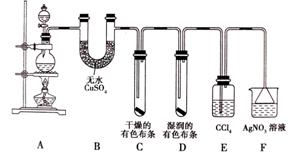
试回答下列问题:
(1) 下列方法中,可制得氯气的是________________。
① MnO2和浓盐酸混合共热 ② MnO2、NaCl和浓硫酸混合共热
③ 次氯酸钠和浓盐酸混合 ④ KClO3和浓盐酸混合共热
⑤ KMnO4和浓盐酸混合
(2) 若用含有0.2mol HCl 的浓盐酸与足量MnO2反应制取Cl2,制得的Cl2在标准状况下的体积总是小于1.12L的原因是___________________________________。
(3) ①装置B的作用是__________,现象是______________________________。
②装置C和D出现的不同现象说明的问题是___________________________________。
③装置E 的作用应该是___________________________________________。
④写出装置F中发生反应的离子方程式_______________________________。
(4)乙同学认为甲同学的实验有缺陷,不能确认最终通入AgNO3溶液中的气体只有一种,为了保证实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在______之间(填装置字母序号),装置中应加入_______________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com