
题目列表(包括答案和解析)
28.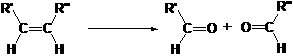 已知:
已知:
某一元氯代烃A分子式为C6H11Cl,可以发生如下图所示的转化: www.k@s@5@ 高#考#资#源#网
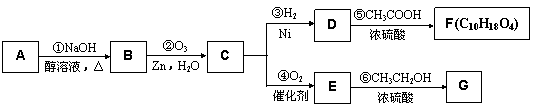

结构分析表明F分子中含有两个甲基。请回答下列问题:
(1)G的分子式为_____________。
(2)写结构简式:A________________________,E___________________________。
(3)A→B的反应方程式是_______________________________________________________________________。
D→F的反应方程式是_______________________________________________________________________。
(4)F 和 G____________(能或不能)互称为同分异构体。
(5)分子式和E相同,主链含有3个碳原子的二元羧酸的同分异构体有_______种。
28.SnCl4的制备需分两步进行,第一步是金属Sn的制备,第二步由Sn和Cl2反应生成SnCl4。
第一步:金属Sn的制备--以锡石SnO2为原料,用足量的焦炭作还原剂,在高温下可制得粗锡,该反应的化学方程式为:_______________________________________,粗锡经电解精炼可得纯锡,精炼时的阴极反应式为_________________________。
第二步:SnCl4的制备--用干燥、纯净的Cl2与熔融的Sn反应制SnCl4,同时放出大量的热。已知SnCl4常温下是无色液体,沸点114℃,遇潮湿空气便发生水解反应,Sn的熔点:231℃,下图是制取SnCl4的实验装置
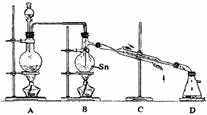
试回答以下问题:
(1)装置A中反应的化学方程式为 。
(2)当反应生成SnCl4时,应熄灭 处的酒精灯,理由是 。
(3)装置B的主要缺点是___________________。装置D的主要缺点是______________________________________________________。
(4)即使装置B和装置D进行改进后,老师说该实验装置设计仍不完整,请你协助该研究小组设计出所缺装置(须标出试剂的名称)并在下边方框中画出。
26.2007年10月24日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥一号”探月卫星成功送入太空,迈出了向广寒宫求索的第一步。“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,第三级为液态氧燃料。
(1)常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-543kJ·mol-1
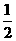 H2(g)+
H2(g)+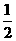 F2(g)=HF(g);△H=-269kJ·mol-1
F2(g)=HF(g);△H=-269kJ·mol-1
H2(g)+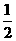 O2(g)=H2O(g);△H=-242kJ·mol-1
O2(g)=H2O(g);△H=-242kJ·mol-1
请写出肼和氟气反应的热化学方程式:__________________________________________。
(2)氢是一种理想的绿色能源,最近科学家利用太阳光分解水来制备氢。下图为光分解水制氢的循环系统,反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe2+等可循环使用。 www.k@s@5@ 高#考#资#源#网
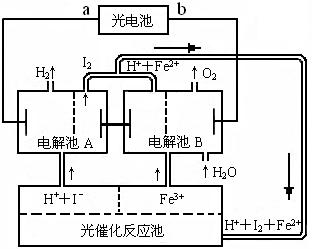
①判断光电池的a端为_________极,b端为________极。
②写出电解池A中电极反应式:
阴极___________________________,
阳极_____________________________。
③电解池B中反应的离子方程式
__________________________________________。
④若电解池A中生成H2的体积为8.96L(标准状况下),
则电解池B中生成Fe2+的物质的量为____________________。
25.已知A是一种有色溶液,B是由三种短周期元素组成的分子,摩尔质量为60g/mol,且分子中三个原子在一条直线上,C是一种无色液体,K、N是非金属单质,J是一种淡黄色粉末,F是造成温室效应的主要气体,③④是工业生产中的重要反应。它们的关系如下图.
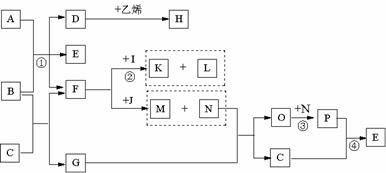
试回答下列问题
(1)G的化学式为: M的化学式为: H的结构简式为: 。
(2)B的电子式: 。B的沸点比F高,是因为: 。
(3)工业生产中反应③、④发生的设备是_______、_________
(4)反应②的化学方程式为: ;
反应①的离子方程式为: 。
13.将5.6 g Fe投入浓硝酸溶液,产生红棕色气体A,把所得溶液减压蒸干,得到20g Fe(NO3)2和Fe(NO3)3的混合物,将该固体在高温下加热,得到红褐色的Fe2O3和气体B,A、B气体混合通入足量水中,在标准状况下剩余气体的体积为( )
A.2240mL B.4480mL C.3360mL D.1120mL
12.聚乙炔导电聚合物的合成使高分子材料进入“合成金属”和塑料电子学时代,当聚乙炔分子带上药物、氨基酸、糖基等分子片后,就具有一定的生物活性。以下是我国化学家近年来合成的一些聚乙炔衍生物分子的结构式:(Me指甲基)
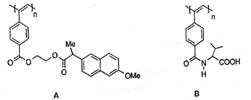
下列关于上述高分子的说法不正确的是( )
A.A和B均能在一定条件下水解,且水解形成相同的高分子
B.A水解所得的药物小分子羧酸的分子式为C14H14O3
C.B水解所得的小分子是一种α-氨基酸
D.A和B各1mol与热碱液反应,均最多消耗2 mol NaOH www.k@s@5@ 高#考#资#源#网
11.在298K、1.01×105Pa下,将22g CO2通入1mol·L-1 NaOH溶液750mL中充分反应,测得反应放出x kJ的热量。已知该条件下,1mol CO2通入2mol·L-1 NaOH溶液1L中充分反应放出y kJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的( )
A.CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(2y-x)kJ·mol-1
B.CO2(g)+NaOH(aq)=NaHCO3(aq) △H=(4x-y)kJ·mol-1
C.CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(4x-y)kJ·mol-1
D.2CO2(g)+2NaOH(aq)=2NaHCO3(aq) △H=-(8x-2y)kJ·mol-1
10.对于反应N2O4(g)
 2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )
2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )
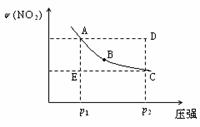
A.A、C两点的正反应速率的关系为A>C
B.A、B、C、D、E各状态中,v(正)<v(逆)的是状态E
C.维持p1不变,E→A所需时间为x;维持p2不变,D→C所需时间为y,则x<y。
D.使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是从p1突然加压至p2,再由p2无限缓慢降压至p1
9.常温下,由水电离出的氢离子浓度为1×10-13mol/L的溶液中,一定不能大量共存的离子组是( )
A.Cl- AlO2- Na+ K+ B.Mg2+ NO3- Br- K+
C.Fe2+ Cl- Ba2+ Cl- D.SO32- Na+ S2- K+ www.k@s@5@ 高#考#资#源#网
8.设NA表示阿伏加德罗常数,下列说法正确的是( )
A.标准状况下1molHCl与HF的混合物的体积约为22.4L
B.0.5L0.5mol/L的NaNO3溶液中含有的粒子总数约为0.5×6.02×1023
C.1.72g生石膏(CaSO4·2H2O) 转化为熟石膏(2CaSO4·H2O) 失去的结晶水数目为0.015NA
D.9 g重水所含有的电子数为5NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com