
题目列表(包括答案和解析)
1.化学与生活密切相关,下列有关说法正确的是( )
A.维生素C具有还原性,在人体内起抗氧化作用
B.糖类、蛋白质、油脂都属于天然高分子化合物
C.煤经气化和液化两个物理变化过程,可变为清洁能源
D.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料
11. (16分)(根据常州市2010-2011学年第一学期期末调研高三化学试题改编)
某芳香烃A(相对分子质量为92)是一种重要的有机化工原料,以它为初始原料经过如下转化关系图(部分产物、合成路线、反应条件略去)可以合成阿司匹林、扁桃酸等物质。其中D能与银氨溶液发生银镜反应。
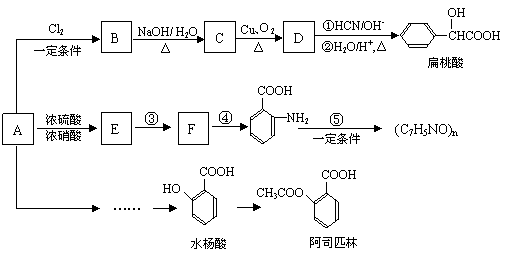
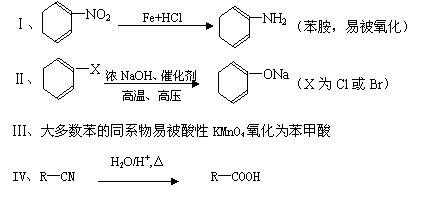 已知:
已知:
⑴B的结构简式为: 。
D转化成扁桃酸的第一步的反应类型为: 。
⑵符合下列条件的扁桃酸的同分异构体共有 种。
①属于甲酸酯 ②含有酚羟基
⑶反应③和④顺序能否对换? ;(填“能”或“不能”)
理由是: 。
⑷写出扁桃酸发生缩聚的化学方程式: 。
⑸写出反应D与银氨溶液的化学方程式: 。
⑹试写出由A合成水杨酸的合理流程图:
①合成过程中无机试剂任选
②合成反应流程图表示方法示例如下:
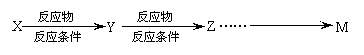
ww.k@s@5@ 高#考#资#源#网
10.(14分)(原创)在食品加工领域,应用二氧化硫的最主要原因是避免氧化和防腐。在我国葡萄酒中二氧化硫的最大使用量为0.2500g/kg,二氧化硫残留量不得超过0.05000g/kg。葡萄酒中的二氧化硫包括游离的和结合的,因而加人氢氧化钾使之破坏其结合状态,并使之固定S02+2KOH == K2S03+H20;然后加入硫酸又使二氧化硫游离,K2S03+H2S04 == K2S04+H2O+S02↑;加入过量的I2氧化S02;过量的I2可用硫代硫酸钠进行滴定,I2+2Na2S203== Na2S406+ 2NaI。
以下是某实验小组测定某品牌的干白葡萄酒(密度为1.12g/ml)中二氧化硫的含量是否超标的实验方案。
实验步骤:
①用移液管量取50.00ml样品于250ml锥形瓶中,加入25.00 ml1mol/L氢氧化钾溶液,加塞,摇匀;ww.k@s@5@ 高#考#资#源#网
②静置15min;
③打开塞子,加入25.00ml1:3硫酸溶液使溶液呈酸性,再加入25.00ml0.01000mol/L碘溶液,迅速的加塞,摇匀;
④用 滴定管移取步骤③中溶液25.00ml,加入适量0.1%的A溶液作指示剂,立即用浓度为0.002000mol/L的硫代硫酸钠溶液滴定,并记录消耗硫代硫酸钠溶液的体积;
⑤重复以上实验2次;
⑥数据处理,得出结论。
请回答下列问题:
(1)以上实验方案中步骤③中加碘溶液时发生的离子反应方程式是: ;
(2)步骤①-③中始终要将锥形瓶加塞进行操作的原因是 ;
(3)步骤④的A溶液最合适的是 ;滴定终点的判断方法是 ;
(4)步骤④应该选用 (填空“酸式”或“碱式”)滴定管;
(5)该小组三次实验消耗的Na2S203溶液的体积数据记录如下:
|
序号 |
滴定前/mL |
滴定后/mL |
|
① |
1.35 |
19.40 |
|
② |
1.05 |
19.00 |
|
③ |
1.58 |
20.91 |
根据数据计算该样品中总二氧化硫的浓度为 mol/L,故该干白葡萄酒是 (填“合格”“不合格”)产品。
9. (14分)(根据肇庆市2011届高三级第一次模拟试题改编)
请回答下列问题:
(1)现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的广泛用途。
①已知:2C(s)+O2(g)=2CO(g);ΔH1 , 2H2(g)+O2(g)=2H2O(g);ΔH2 。
则反应C(s)+H2O(g)  CO(g)+H2(g);ΔH=
。(用含ΔH1、ΔH2的代数式表示)
CO(g)+H2(g);ΔH=
。(用含ΔH1、ΔH2的代数式表示)
②CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)  CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。ww.k@s@5@
高#考#资#源#网
CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。ww.k@s@5@
高#考#资#源#网
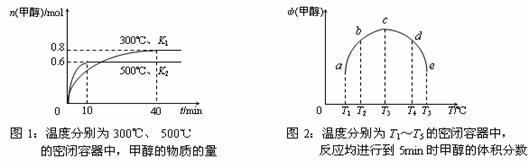
a. 该反应的ΔH3 0(选填“<”、“>”或“=”,下同),K1 K2。
b. 将容器d中的平衡状态转变到容器c中的平衡状态,可采取的措施有 。
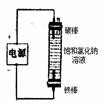
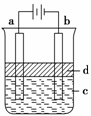 (2)利用电解实验可以制得纯净的Fe(OH)2白色沉淀,如图所示,已知两电极的材料分别为石墨和铁。
(2)利用电解实验可以制得纯净的Fe(OH)2白色沉淀,如图所示,已知两电极的材料分别为石墨和铁。
(a)a电极反应式为 。
(b)电解液c可以是 (填编号)。
A、纯水 B、NaCl溶液 C、H2SO4溶液 D、CuCl2溶液
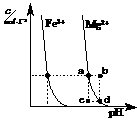 (3)右图为某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度变化情况。据图分析:
(3)右图为某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度变化情况。据图分析:
该温度下,溶度积常数的关系为:Ksp[ Fe(OH)3]____Ksp[Mg(OH)2]
(填:>、=、<);如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是
。
8. (14分)(根据湖北省监利一中2011届高三年级理科化学测试(九)改编)
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请填空:
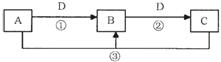
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则
①B的化学式可能是 ;
②工业上制取A的离子方程式为 ;其中两种产物可与KI溶液反应制得一种化工原料,若消耗0.1 mol KI转移电子0.6 mol,则三种物质间反应的离子方程式是 。
③B可作净水剂,在使用时发现B不能使酸性废水中的悬浮物沉降除去,其原因是 。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应③的化学方程式为 。
(3)若D是氯碱工业的主要产品,B有两性,则反应②的离子方程式是 。
(4)若D空气质量预报必报的气体,A、B、C的的焰色反应都呈黄色,则可以证明B是否变质的一组试剂是 (请写出试剂名称)。
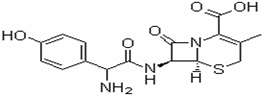
7. (原创)头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应极小,因而被广泛适用于敏感细菌所致的尿路感染、皮肤软组织感染以及急性扁桃体炎、急性咽炎、中耳炎和肺部感染等的治疗。已知肽键可以在碱性条件下水解。
下列对头孢羟氨苄的说法中正确的是ww.k@s@5@ 高#考#资#源#网
 ·H2O
·H2O
A.头孢羟氨苄的化学式为C16H16N3O5S·H2O
B. 1mol头孢羟氨苄与NaOH溶液和浓溴水反应时,分别需要消耗NaOH 4mol和Br2 3mol
C.在催化剂存在的条件下,1mol头孢羟氨苄消耗7molH2
D. 头孢羟氨苄能在空气中稳定存在
6. (原创) 向含1mol HNO3和1mol MgSO4的混合溶液中加入1 mo1·L-1Ba(OH)2溶液,产生沉淀的质量(m)与加入Ba(OH)2溶液体积(V)间的关系图正确的是
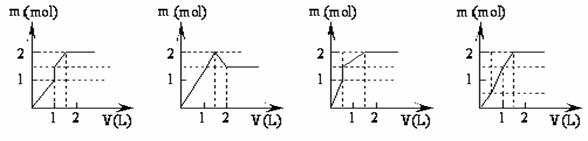
A B C D
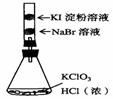
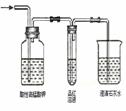
5. (原创)实验室里运用下列实验装置进行实验,能达到相应实验目的并符合环保的是
|
A |
B |
C |
D |
 |
 |
 |
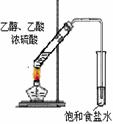 |
|
完成氯气的性质实验 |
制取84消毒液(NaClO) |
检验二氧化硫中是否混有二氧化碳 |
制取乙酸乙酯 |
4. (原创)网易探索2010年5月20日报道,来自法国格勒诺布尔(Grenoble)约瑟夫·傅立叶大学的研究小组发明了第一块可为人体人造器官提供电能的可植入的葡萄糖生物燃料电池,其基本原理是葡萄糖和氧气在人体中酶的作用下发生的总反应为C6H12O6+6O2=6CO2+6H2O(酸性环境),下列对该电池说法不正确的是
A. 该生物燃料电池可以在高温下工作
B. 电池的负极反应为:C6H12O6+6H2O-24e-=6CO2+24H+
C. 今后研究的研究方向是怎样提高葡萄糖生物燃料电池的效率,从而在将来达到可以利用葡萄糖生物燃料电池为任何可植入医疗设备提供电能
D. 消耗1mol氧气则转移4mole-,H+会向正极移动
3. (原创)下列热化学方程式或离子方程式中,正确的是
A.碳酸钠溶液中滴加少量的硫酸氢钠溶液:CO32- + H+ == HCO3-
|

 N2(g) + 3H2(g)
2NH3(g)
△H=-38.6kJ·mol-1ww.k@s@5@
高#考#资#源#网
N2(g) + 3H2(g)
2NH3(g)
△H=-38.6kJ·mol-1ww.k@s@5@
高#考#资#源#网
C.醋酸铵溶液中的水解离子方程式:C H3COO- + H2O  C H3COO H+ OH-
C H3COO H+ OH-
D. 尼泊金酸(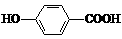 )与碳酸氢钠溶液反应:
)与碳酸氢钠溶液反应:
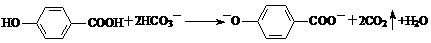
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com