
题目列表(包括答案和解析)
1.常温时,以下4种溶液pH最小的是
(A)0.01 mol·L-1 醋酸溶液
(B)0.02 mol·L-1醋酸与0.02 mol·L-1NaOH溶液等体积混合液
(C)0.03 mol·L-1醋酸与0.01 mol·L-1NaOH溶液等体积混合液
(D)pH=2的盐酸与pH=12的NaOH溶液等体积混合液
26、(8分)2.80g铁与100mL稀硝酸混合充分的反应,产生气体为NO,反应后铁、硝酸均无剩余。向反应后的溶液中加入100mL 0.2mol/L的碘化钾溶液,恰好将溶液中的Fe3+全部还原,求原硝酸溶液的物质的量浓度。
0.8mol/L,起始时,向丙容器中加入C、D的物质的量分别为3mol、2mol,则还需
加入A、B的物质的量分别是___________、___________。
(4)若要使甲、乙容器中B的平衡浓度相等,可以采取的措施是___________。
A.保持温度不变,增大甲容器的体积至2L
B.保持容器体积不变,使甲容器降低温度
C.保持容器压强和温度都不变,向甲中加入一定量的A气体
D.保持容器压强和温度都不变,向甲中加入一定时的B气体
25.(15分)T℃时,有甲、乙两个密闭容器,甲容器的体积为1L,乙容器的体积为2L,分别向甲、乙两容器中加入6mol A和3mol B,发生反应如下:
3A(g)+b B(g)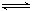 3C(g)+2D(g),
3C(g)+2D(g),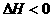 (正向为放热反应);4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;t
min后乙容器内的反应达到平衡,B的浓度为0.8mol/L。根据题给的信息回答下列问题:
(正向为放热反应);4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;t
min后乙容器内的反应达到平衡,B的浓度为0.8mol/L。根据题给的信息回答下列问题:
(1)甲容器中反应的平均速率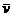 (B)=_________,化学方程式中计量数b=________。
(B)=_________,化学方程式中计量数b=________。
(2)乙容器中反应达到平衡所需时间t_________4min(填“大于”、“小于”或“等于”),
原因是___________________________________________________________。
(3)T℃时,在另一个体积与乙相同的丙容器中,为了达到平衡时B的浓度仍然为
24.(14分)如图所示,各物质间存在如下相互转化关系,其中F为金属,能和氧化铁反应,生成铁单质。E和K为无色气体单质,其它物质均为化合物,A为无色气体且通入澄清石灰水有浑浊出现,C为无色液体。
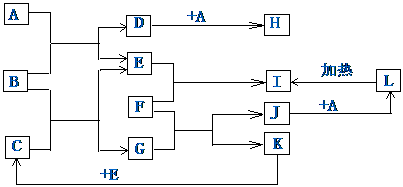
试回答下列问题:
(1)写出F与氧化铁反应的化学反应方程式 。
(2)写出E的名称: ,气体A的分子属于 (极性、非极性)分子,
(3)化合物B的电子式为:
(4)写出B与C反应的化学方程式:
(5)写出J生成L的离子反应方程式: ,
(6)写出H的固体转化为D的化学反应方程式:
。
23、(9分)已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH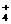 、Ba2+、Na+、H+、SO
、Ba2+、Na+、H+、SO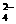 、NO
、NO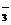 、OH-、CO
、OH-、CO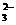 。将这四种溶液分别标记为A、B、C、D,进行如下实验:
。将这四种溶液分别标记为A、B、C、D,进行如下实验:
①在A或D中滴入C,均有沉淀生成
②D和B反应生成的气体能被A吸收
③A和D反应生成的气体能被B吸收
试回答下列问题:
(1)D的化学式是 ,判断理由是
。
(2)写出其余几种物质的化学式:A B C
(3)写出实验②中有关反应的离子方程式
22、含ng HNO3的稀溶液恰好与mg铁粉完全反应,若HNO3只被还原为NO,n∶m可能是 ① 5∶1 ② 9∶2 ③ 3∶1 ④ 2∶1 ⑤ 4∶1 ( )
A ②③⑤ B ①③④ C ②③ D ①③⑤
第Ⅱ卷(共46分)
21、 一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g) 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a
%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数小于a %的是
( )
一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g) 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a
%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数小于a %的是
( )
A.2 mol C B.2 mol A、1 mol B和1 mol He(不参加反应)
C.1 mol B和1 mol C D.2 mol A、3 mol B和3 mol C
20、碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是 ( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
19、下列各组离子一定能大量共存的是 ( )
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.在强碱溶液中:Na+、K+、AlO2-、CO32-
C.在C(H+)=10-13mol/L的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com