(2012?青浦区二模)己知:2Fe
3++2I
-→2Fe
2++I
2,I
2+2S
2O
32-→2I
-+S
4O
62一氯化铁是常见的水处理剂.某氯化铁( FeCl
3-6H
2O)样品含有少量FeCl
2杂质.现要测定其中FeCl
3-6H
2O的质量分数,实验按以下步骤进行:

(1)取少量氯化铁样品滴入50mL沸水中,加热片刻,液体呈现红褐色,反应的离子方程式
Fe3++3H2O?Fe(OH)3+3H+
Fe3++3H2O?Fe(OH)3+3H+
(2)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有
100ml容量瓶
100ml容量瓶
、
胶头滴管
胶头滴管
(填仪器名称).
(3)操作II必须用到的仪器是
d
d
(选填编号);
a.50mL烧杯 b.l0mL量筒 c.20mL量筒 d.25mL滴定管
指示剂是淀粉溶液,则达到滴定终点的现象是
滴入最后一滴溶液蓝色变化为无色且半分钟不变化
滴入最后一滴溶液蓝色变化为无色且半分钟不变化
.
(4)滴定时,消耗浓度为0.1000mol/L的标准Na
2S
2O
3溶液18.17mL.该样品中FeCl
3-6H
2O的质量分数为
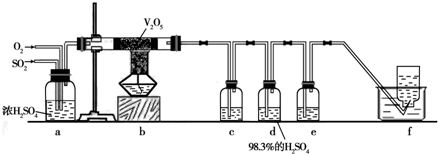
98.3%
98.3%
.
(5)要把样品氯化铁中的少量FeCl
2杂质除去,可用的试剂是
bd
bd
(选填编号).
a.铁粉 b.氯水 c.溴水 d.双氧水
(6)如果采用以下步骤测定氯化铁样品中铁元素的含量,完成下列填空.
①称量样品 ②加水溶觯 ③加足量氨水,沉淀 ④过滤 ⑤灼烧 ⑥称量并进行恒重操作.
还缺少的一步操作是
洗涤
洗涤
;在过滤前,需要检验是否沉淀完全,其操作是
沉淀静置在层清液中,加入氨水溶液观察有无沉淀生成,若无沉淀生成,证明沉淀完全
沉淀静置在层清液中,加入氨水溶液观察有无沉淀生成,若无沉淀生成,证明沉淀完全
判断是否恒重的标准是
两次称量的质量相等或相差不超过0.001g
两次称量的质量相等或相差不超过0.001g
.

 )和某合成鞣剂(
)和某合成鞣剂(  )的原料之一.相关的合成路线如下图所示(某些生成物已略去):
)的原料之一.相关的合成路线如下图所示(某些生成物已略去):
 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)





 ,X的结构简式为
,X的结构简式为