
题目列表(包括答案和解析)
| 催化剂 |
| △ |
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |

 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的.难溶金属的氢氧化物在不同pH下的溶解度(s,mol?L-1)见图.
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的.难溶金属的氢氧化物在不同pH下的溶解度(s,mol?L-1)见图.| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
| 1 |
| 3 |
| A、[Co(NH3)4]Cl3 |
| B、[Co(NH3)4Cl3] |
| C、[Co(NH3)4Cl]Cl2 |
| D、[Co(NH3)4Cl2]Cl |
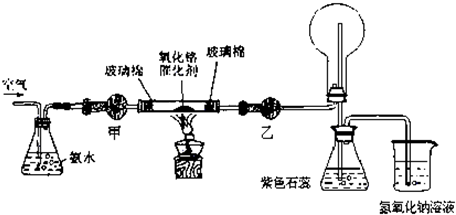
| ||
| 加热 |
| ||
| 加热 |
一、单项选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.D 2.C 3.B 4.D 5.C 6.A 7.B 8.D
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
9.CD 10.AD 11.D 12.C 13.BC 14.D
三、(本题包括1小题,共14分)
15.
方案一:
(1)在白瓷板或玻璃片上放一小片pH试纸,将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较
(2)排除因盐酸的加入,稀释氢氧化钠溶液而引起pH减小
方案二:
(1)赶走溶液中少量氧气,隔绝氧气
 (2)CO32―+H2O HCO3―+OH―
(2)CO32―+H2O HCO3―+OH―
(3)做对比实验,取上述NaOH溶液稀释,加入酚酞溶液出现红色且不褪去
方案三:
(1)7 (2)U形管中左边液面下降
(每空2分,共14分)
四、(本题包括2小题,共18分)
16.
⑴ 

⑵CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-
⑶Al4SiC4+2N2 4AlN+SiC+
4AlN+SiC+
⑷可行,该反应是一个焓减、熵略大于0的反应,能自发进行
(每空2分,共8分)
17.
⑴ CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4
生成的CaCO3溶解度小于CaSO4有利于反应向正向进行。
⑵)BCD ⑶CO2 ⑷ABD(每空2分,共10分)
 五、(本题包括1小题,共10分)
五、(本题包括1小题,共10分)
18.
⑴见图示(2分 ,其中过渡元素涂对得1分)
⑵  ⑶ r(Cl-)>r(K+)
⑶ r(Cl-)>r(K+)
⑷ ②④ (5) 
(除⑴外其余每空2分,共10分)
 六、(本题包括1小题,共10分)
六、(本题包括1小题,共10分)
19.
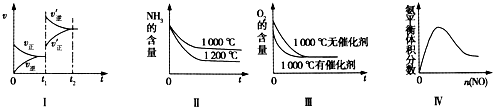
⑴①增大压强 t3~t4 ②
⑵①如图 ②适当增大压强,研究新催化剂
(每空2分,共10分)
七、(本题包括1小题,共8分)
20.
⑴ 2 第2周期第VIA族 (各1分,共2分)
⑵1s22s22p63s23p63d64s2
⑶H+ + AlO2-
+ H2O Al(OH)3
Al(OH)3 Al3+ + 3H2O
Al3+ + 3H2O
⑷4Fe(OH)2 + 2H2O+ O2=4Fe(OH)3
(除⑴外其余每空2分,共8分)
八、(本题包括1小题,共12分)
21.
⑴-80kJ?mol―1
⑵用过量的稀硫酸溶解过量的镁,不断搅拌,过滤,洗净、干燥
⑶加快反应速率,促进平衡向水解的方向移动
⑷取少量洗涤液,在其中加入AgNO3(或BaCl2),无沉淀生成则说明无相应离子。
Ag++Cl-=AgCl↓ Ba2++SO42-=BaSO4↓
(每空2分,共8分)
Ⅲ 1.5mol/L(4分,分步给分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com