
金属及其化合物在人类生活、生产中发挥着重要的作用.
(1)将一小块金属钠投入盛有水的烧杯中,发生反应的化学方程式为:
2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
,
可观察到的实验现象是
bc
bc
(填序号).
a.钠沉到水底 b.钠熔成小球 c.钠球四处游动 d.溶液呈红色
(2)在钠、铝、铁三种金属元素中,其所形成氧化物种类最多的是
铁
铁
,所形成的
氧化物中适宜做耐火材料的是
铝
铝
.向盛有硫酸铝溶液的试管中滴加氨水,反应的离子方程式为
Al3++3NH3.H2O=Al(OH)3↓+3NH4+
Al3++3NH3.H2O=Al(OH)3↓+3NH4+
,得到的胶状沉淀物因具有
吸附性或弱碱
吸附性或弱碱
性,可用于
吸附性、净水或治疗胃酸过多
吸附性、净水或治疗胃酸过多
.
(3)取少量FeCl
2溶液,按如图所示的操作,使其跟NaOH溶液反应.可观察到的现象是
产生白色沉淀,迅速变灰绿,直至红褐色
产生白色沉淀,迅速变灰绿,直至红褐色
,与上述现象相关的反应的化学方程式:
FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3↓
FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3↓
.
(4)向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
B
B
.
A.有铜无铁B.有铁无铜 C.铁、铜都有 D.铁、铜都无.



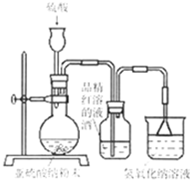
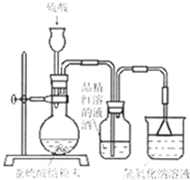
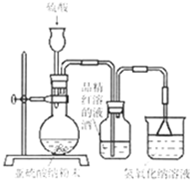 (2012?杭州一模)某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.
(2012?杭州一模)某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题. 金属及其化合物在人类生活、生产中发挥着重要的作用.
金属及其化合物在人类生活、生产中发挥着重要的作用.