
自然界里氮的固定途径之一是在闪电的作用下,N
2与O
2反应生成NO.
(1)在不同温度下,反应N
2(g)+O
2(g)?2NO(g)△H=a kJ?mol
-1的平衡常数K如下表:
| 温度/℃ |
1538 |
1760 |
2404 |
| 平衡常数K |
0.86×10-4 |
2.6×10-4 |
64×10-4 |
①该反应的a
>
>
0(填“>”、“=”或“<”).
②其他条件相同时,在上述三个温度下分别发生该反应.
1538℃时,N
2的转化率随时间变化如图所示,请补充完成1760℃时N
2的转化率随时间变化的示意图.
(2)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N
2和2.6mol O
2,计算反应N
2(g)+O
2(g)?2NO(g)达到平衡时NO的浓度.(此温度下不考虑O
2与NO的反应.计算结果保留两位有效数字)
(3)科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N
2在催化剂(掺有少量Fe
2O
3的TiO
2)表面与水发生反应,生成的主要产物为NH
3.相应的热化学方程式如下:
2N
2(g)+6H
2O(1)=4NH
3(g)+3O
2(g)△H=+1530kJ?mol
-1则氨催化氧化反应4NH
3(g)+5O
2(g)=4NO(g)+6H
2O(1)的反应热△H=
(2a-1530)kJ?mol-1
(2a-1530)kJ?mol-1
.(用含a的代数式表示)
(4)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H
+)实现氮的固定--氨的电解法合成,大大提高了氮气和氢气的转化率.总反应式为:N
2+3H
2?2NH
3.则在电解法合成氨的过程中,应将H
2不断地通入
阳
阳
极(填“正”、“负”、“阴”或“阳”);在另一电极通入N
2,该电极反应式为
N2+6H++6e-=2NH3
N2+6H++6e-=2NH3
.

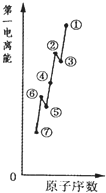 物质结构的多样性让人类使用的材料精彩纷呈.
物质结构的多样性让人类使用的材料精彩纷呈.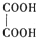 ,草酸钠晶体中存在
,草酸钠晶体中存在

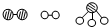 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别为
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别为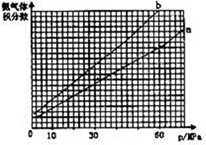
 (2010?聊城二模)I.科学家一直致力于“人工固氮”的新方法研究.
(2010?聊城二模)I.科学家一直致力于“人工固氮”的新方法研究. 自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.