
题目列表(包括答案和解析)
二氧化氧
(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.与Cl2相比ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl![]() 2ClO2↑+Cl2↑+2NaCl+2H2O
2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:
2NaClO3+H2O2+H2SO4用方法二制备的
ClO2更适合用于饮用水的消毒,其主要原因是________.(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子的含量应不超过0.2 mg·L-1.
饮用水中CIO2、CIO2的含量可用连续碘量法进行测定.CIO2被I-还原为CIO-2、Cl-的转化率与溶液pH的关系如图所示.当pH≤2.0时,CIO-2也能被I-完全还原成Cl-.反应生成的I2用标准Na2S2O3溶液滴定:
2Na2S2O3+I2![]() Na2S4O6+2NaI
Na2S4O6+2NaI

①请写出
pH≤2.0时,CIO-2与I-反应的离子议程式________.②请完成相应的实验步骤:
步骤
1:准确量取VmL水样加入到锥形瓶中.步骤
2:调节水样的pH为7.0~8.0.步骤
3:加入足量的KI晶体.步骤
4:加少量淀粉溶液,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL.步骤
5:________.③根据上述分析数据,测得该饮用水样中
CIO-2的浓度为________mol·L-1(用含字母的代数式表示.)④若饮用水中
ClO-2的含量超标,可向其中加入适量的Fe2+将ClO-2还原成Cl-,该反应的氧化产物是________(填化学式).(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl====2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4====2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是_____________________。
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(![]() )。2001年我国卫生部规定,饮用水中
)。2001年我国卫生部规定,饮用水中![]() 的含量应不超过0.2 mg·L-1。
的含量应不超过0.2 mg·L-1。
饮用水中ClO2、![]() 的含量可用连续碘量法进行测定。ClO2被I-还原为
的含量可用连续碘量法进行测定。ClO2被I-还原为![]() 、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2.0时,
、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2.0时,![]() 也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:
也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:

2Na2S2O3+I2====Na2S4O6+2NaI
①请写出pH≤2.0时,![]() 与I-反应的离子方程式___________________________________。
与I-反应的离子方程式___________________________________。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加少量淀粉溶液,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1 mL。
步骤5:_________________________________。
步骤6:再用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
③根据上述分析数据,测得该饮用水样中![]() 的浓度为________________mol·L-1 (用含字母的代数式表示)。
的浓度为________________mol·L-1 (用含字母的代数式表示)。
④若饮用水中![]() 的含量超标,可向其中加入适量的Fe2+将
的含量超标,可向其中加入适量的Fe2+将![]() 还原成Cl-,该反应的氧化产物是____________________________(填化学式)。
还原成Cl-,该反应的氧化产物是____________________________(填化学式)。

二氧化氯(ClO2)是一种广谱、高效的消毒剂,易溶于水,尤其在水处理等方面有广泛应用。以下是某校化学研究小组设计实验室制取ClO2的工艺流程图。下列有关说法正确的是(?? )
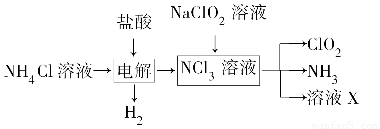
A.电解时发生反应的化学方程式为2HCl Cl2↑+H2↑
Cl2↑+H2↑
B.由NaClO2溶液制取0.6 mol ClO2时,至少消耗0.1 mol NCl3
C.将产生的混合气体通过盛有碱石灰的干燥器以除去ClO2中的NH3
D.溶液X的主要成分为NaClO2和NaOH

A.电解时发生反应的化学方程式为2HCl Cl2↑+H2↑ Cl2↑+H2↑ |
| B.由NaClO2溶液制取0.6 mol ClO2时,至少消耗0.1 mol NCl3 |
| C.将产生的混合气体通过盛有碱石灰的干燥器以除去ClO2中的NH3 |
| D.溶液X的主要成分为NaClO2和NaOH |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com