
题目列表(包括答案和解析)
碱式碳酸镁和无水氯化镁具有广泛的用途。
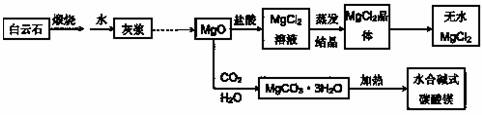
●用白云石(CaCO3?MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如下:
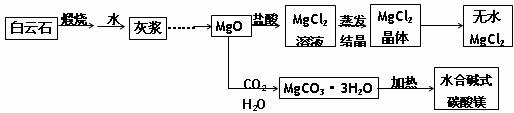
回答下列问题:
(1)“灰浆”中除水和MgO处,主要成分还有:_____________。
(2)从MgCl2晶体得到无水MgCl2的操作为:________________。
●为探究所制得的水合碱式碳酸镁(mMgCO3?nMg(OH)2?xH2O)的组成,某同学组装仪器如图所示:
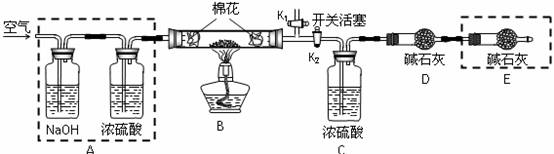 (3)实验测得:硬质玻璃管中剩余的固体质量为1.60g,C处浓H2SO4增重0.72g,D处碱石灰增重1.32g,则此水合碱式碳酸镁的化学式为:______________。
(3)实验测得:硬质玻璃管中剩余的固体质量为1.60g,C处浓H2SO4增重0.72g,D处碱石灰增重1.32g,则此水合碱式碳酸镁的化学式为:______________。
(4)A框中装置的作用是______________;在装好试剂后,加热前应进行的操作是_____。
(5)若将E框中的装置去掉,对实验结果的影响是_______________________。
碱式碳酸镁和无水氯化镁具有广泛的用途。
●用白云石(CaCO3?MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如下:
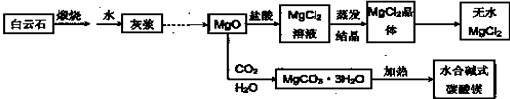
回答下列问题:
(1)“灰浆”中除水和MgO外,主要成分还有:
(2)从MgCl2晶体得到无水MgCl2的操作为:
●为探究所制得的水合碱式碳酸镁(m MgCO3?n Mg(OH)2?x H2O)的组成。某同学组装仪器如图所示:
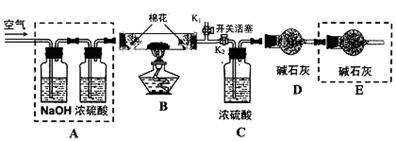
(3)实验测得:硬质玻璃管中剩余的固体质量为1.60g,C处浓H2SO4增重0.72g,D处碱石灰增重1.32g,此水合碱式碳酸镁的化学式为:
(4)A框中装置的作用是 ;在装好试剂后,加热前应进行的操作是
。
(5)若将E框中的装置去掉,对实验结果的影响是 。
碱式碳酸镁和无水氯化镁具有广泛的用途。
●用白云石(CaCO3?MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如下:
回答下列问题:
(1)“灰浆”中除水和MgO外,主要成分还有:
(2)从MgCl2晶体得到无水MgCl2的操作为:
●为探究所制得的水合碱式碳酸镁(m MgCO3?n Mg(OH)2?x H2O)的组成。某同学组装仪器如图所示:
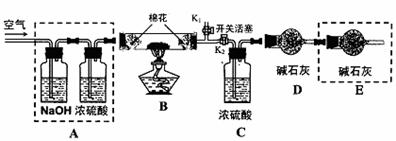
(3)实验测得:硬质玻璃管中剩余的固体质量为1.60g,C处浓H2SO4增重0.72g,D处碱石灰增重1.32g,此水合碱式碳酸镁的化学式为:
(4)A框中装置的作用是 ;在装好试剂后,加热前应进行的操作是 。
(5)若将E框中的装置去掉,对实验结果m的值影响是 (填‘偏大’或‘偏小’或‘不变’)
| 滴定次数 | 待测溶液体积/mL | 草酸溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0 (另加少量可溶于水MnSO4粉末) |
2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
| 滴定次数 | 待测溶液体积/mL | 草酸溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0 (另加少量可溶于水MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
二.选择题
题号
14
15
16
17
18
19
20
21
答案
B
D
CD
BCD
AD
BD
AC
C
22.(1)①F、I ②A、D ③B点,0.1
(2)
(3)重锤质量m,
23.分析与解:设抛出点的高度为h,第一次平抛的水平射程为x,则有 x2+h2=L2
由平抛运动规律得知,当初速度增大到2倍时,其水平射程也增大到2x,可得
(2x)2+h2=( L)2
L)2
设该星球上的重力加速度为g,由平抛运动的规律得:
h= gt2
gt2
由万有引力定律与牛顿第二定律得: mg= G
联立以上各式解得M= 。
。
24.解析:(1)对BC过程运用动能定理得 ,
, ;
;
(2)在平抛运动过程中因 ,有
,有 ,平抛运动的初速度为
,平抛运动的初速度为 ;
;
(3)由能量守恒知,落地时损失的机械能为 。
。
25. 解析:(1)物块P在AB上滑动时,三个物体组成的系统动量守恒
即  ,有
,有 ;
;
(2)由能量守恒可得 所以
所以 ;
;
(3)在物块P与CD相互作用的过程中,满足动量守恒定律和机械能守恒定律
故 ,
, ,解得:
,解得: 。
。
理综 化学 试题参考答案及评分标准
题号
6
7
8
9
10
11
12
13
答案
C
B
B
D
C
A
.A
C
26.(18分,每空2分)
(1)d e (2)FeC13; 2Fe3++Fe=3Fe2-
用试管取少量C溶液,滴加KSCN溶液,无颜色变化,再滴加氯水(或硝酸),溶液呈血红色,证明原溶液中有Fe2+存在。(答出要点可得分,其他正确答案参照本标准给分)
(3)A1(OH)3;NaOH(或KOH);HC1(或其他强酸);
A13++3OH-=A1(OH)3↓;A1O2-+H+H2O=A1(OH)3↓(其他正确答案可参照本标准给分)
27.(15分)(1)Ca(OH)2(2分)
(2)将晶体在干燥的HCl气流中加热(2分)
(3)3MgCO3?Mg(OH)2?3H2O(3分)
(4)除去空气中的水蒸气和CO2等酸性气体,以减少误差;(3分)
关闭K2,打开K1,通入足量空气后,再打开K2,关闭K1 (3分)
|