
题目列表(包括答案和解析)

| ||
| ||
| ||
| 太阳光 |
| ||
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
 2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
 2H2↑+O2↑
2H2↑+O2↑ 2H2+O2
2H2+O2 2H2↑+O2↑
2H2↑+O2↑ CO+3H2
CO+3H2 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。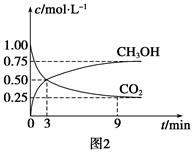
 CH3OH(g)的平衡常数。下列说法正确的是________。
CH3OH(g)的平衡常数。下列说法正确的是________。| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
| ||
| ||


第Ⅰ卷(选择题 共42分)
一、选择题(本题包括14小题,每小题3分,共42分,每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
答案
C
B
C
B
C
A
B
题号
8
9
10
11
12
13
14
答案
C
A
C
D
B
A
C
第Ⅱ卷(共58分)
二、填空题(本题包括4小题,共48分)
15.(13分)
(1)①增大(1分)
②增大 减小(各1分,共2分)
③E(1分)
④t3~t5(1分)
⑤D B(各1分,共2分)
⑥
(2)2NH3+60H--6e-===N2+6H2O(2分) 碱性(1分)
NH3在酸性介质中易转化为NH4+离子(1分)
16.(12分)
(1)第二周期 第VA族(各0.5分共1分)
(2)NH3+H+===NH4+(或H2O+H+===H3O+)(2分)
(3)Al3++3H2O Al(OH)3+3H+(2分)
Al(OH)3+3H+(2分)
(4)NaOH; NH4NO3(各1分共2分)
(5)2H2-4e-+4OH===4H2O(2分)
(6)①A(1分)
②0.25mol2?L-2(或0.25)(2分)
17.(9分)
(1)①吸收CO2中的水蒸汽(或干燥CO2气体)(1分)
②防止空气中的二氧化碳和水蒸汽进入C中(1分)
③C(1分)
(2)①NaOH溶液(1分)
②过滤(1分) 干燥(1分)
③ (2分)
(2分)
(3)方案一中的CO2气体不能完全被装置C中的碱石灰吸收(1分)
18.(14分)
(1)离子键、共价键(或非极性键)(各0.5分共1分)
0.2NA 或1.024×1023 (1分)
(2)Cl2+2OH-===Cl- + ClO- +H2O(2分)
(3)C+2H2SO4(浓)△CO2↑+2SO2↑+2H2O(2分)
(4)NH4++HCO3-+2OH-△NH3↑+CO32-+2H2O(2分)
(或:NH4++HSO3-+2OH-△NH3↑+SO32-+2H2O,
(或:NH4++HS-+2OH-△NH3↑+S2-+2H2O,其它正确答案亦可)
(5)4HCl+NaAlO2===NaCl+AlCl3+2H2O(2分)
(或:4H2SO4+2NaAlO2===Na2SO4+Al2(SO4)3+4H2O,若H2SO4写成硝酸亦可)
(6)2NH4Cl+Ca(OH)2△CaCl2 +2H2O+2NH3↑(2分)
4NH3(g)+5O2(g)===4NO(g)+6H2O(g);△H=-906.8KJ/mol(2分)
三、选做题(本题分A、B两题,考生只要选其中一题作答。若两题都作答,则以A题得分计入总分。本题共10分)
(1)Na<Al<Si<N 高
(2)高 NaCl为离子晶体而SiCl4为分子晶体
(3)三角锥形
(4)1s22s22p63s23p63d104s1(或[Ar] 3d104s1) [Cu(NH3)4]2+
(5)Cu3 N
(6)AlN 共价键
19B.(各1分共10分)
(I)
(II)(1)加成反应 消去反应
(2)浓硫酸、加热
(3) 

(4) 银氨溶液[或新制Cu(OH)2悬浊液]
银氨溶液[或新制Cu(OH)2悬浊液]
(5)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com