
题目列表(包括答案和解析)
①将用分析天平称好的邻苯二甲酸氢钾置于锥形瓶中 ②加适量的蒸馏水溶解,溶液呈无色 ③加入指示剂 ④用NaOH溶液滴定到终点?
某学生进行了三次平行实验,实验数据如下:?
实验编号 | 邻苯二甲酸氢钾的质量/g | 待测NaOH溶液的体积/mL |
1 | 0.612 | 21.20 |
2 | 0.612 | 20.10 |
3 | 0.612 | 19.90 |
试回答下列问题:?
(1)邻苯二甲酸氢钾与NaOH溶液反应的离子方程式是 。?
(2)所加指示剂最好选用 (填“甲基橙”“酚酞”或“石蕊”),判断达到终点的标志是________。
(3)该同学在进行滴定时,左手应该 ,右手应该 ,眼睛应该 。?
(4)第 次实验误差较大,造成这种误差的可能原因是 。?
A碱式滴定管在装NaOH溶液前未用待测NaOH溶液润洗2~3次?
B滴定过程中,振荡太剧烈以致有些溶液飞溅出来?
C滴定开始前尖嘴部分有气泡,在滴定终点读数时没有了气泡?
D达到滴定终点时,俯视读数?
(5)该同学所“标定”的NaOH溶液的物质的量浓度为? ?mol·L-1(结果保留三数)。
①将用分析天平称好的邻苯二甲酸氢钾置于锥形瓶中 ②加适量的蒸馏水溶解,溶液呈无色 ③加入指示剂 ④用NaOH溶液滴定到终点
某学生进行了三次平行实验,实验数据如下:
实验编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
1 | 0.612 | 21.20 |
2 | 0.612 | 20.10 |
3 | 0.612 | 19.90 |
试完成下列问题
(1)邻苯二甲酸氢钾与NaOH溶液反应的离子方程式是_______________________________。
(2)所加指示剂最好选用_____________(填“甲基橙”“酚酞”或“石蕊”)判断达到终点的标志是________________________________________________________________。
(3)该同学在进行滴定时,左手应该___________________,右手应该____________________,眼睛应该___________________。
(4)第_________次实验误差较大,造成这种误差的可能原因是( )
A.碱式滴定管在装NaOH溶液前未用待测NaOH溶液润洗2—3次
B.滴定过程中,振荡太剧烈以致有些溶液飞溅出来
C.滴定开始前尖嘴部分有气泡,在滴定终点读数时没有了气泡
D.达到滴定终点时,俯视读数
(5)该同学所“标定”的NaOH溶液的物质的量浓度为_________mol·L-1(结果保留三位数)。
相对分子质量为204.0)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol•L-1左右,滴定终点时溶液的pH约为9.1。该生用托盘天平称量邻苯二甲酸氢钾时,在左盘放有一个1g砝码,游码位置如图所示:
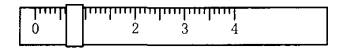
(1)将称好的邻苯二甲酸氢钾放于锥形瓶中,加适量水溶解,溶液无色,再加入指示剂________(从甲基橙、酚酞、石蕊中选择)1~2滴,用NaOH溶液滴定至终点,现象是________。
(2)该生进行三次实验,所取固体质量均相同,填写下表:
实验编号 邻苯二甲酸氢钾质
量/g 待测NaOH溶液体
积/mL
1 18.20
2 17.10
3 16.90
(3)滴定中误差较大的是第________次实验,造成这种误差的可能原因是(只填三种即可):a________b________c________
(4)NaOH溶液的物质的量浓度为(只列出计算式,不必求出结果)。
某学生用邻苯二甲酸氢钾(
相对分子质量为204.0)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol•L-1左右,滴定终点时溶液的pH约为9.1。该生用托盘天平称量邻苯二甲酸氢钾时,在左盘放有一个1g砝码,游码位置如图所示:
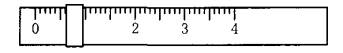
(1)将称好的邻苯二甲酸氢钾放于锥形瓶中,加适量水溶解,溶液无色,再加入指示剂________(从甲基橙、酚酞、石蕊中选择)1~2滴,用NaOH溶液滴定至终点,现象是________。
(2)该生进行三次实验,所取固体质量均相同,填写下表:
实验编号 邻苯二甲酸氢钾质
量/g 待测NaOH溶液体
积/mL
1 18.20
2 17.10
3 16.90
(3)滴定中误差较大的是第________次实验,造成这种误差的可能原因是(只填三种即可):a________b________c________
(4)NaOH溶液的物质的量浓度为(只列出计算式,不必求出结果)。
某学生用邻苯甲酸氢钾( ![]() 相对分子质量为204.0)测定未知的NaOH溶液的浓度,在本实验中到达滴定终点时,溶液的pH约为9.1。
相对分子质量为204.0)测定未知的NaOH溶液的浓度,在本实验中到达滴定终点时,溶液的pH约为9.1。
(1)该学生用托盘天平称量邻苯二甲酸氢钾时(两边均放等质量的纸片),在左盘放一个1g砝码,平衡时游码位置如图所示:
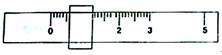
由此可知,所取邻苯二甲酸氢钾的质量为 g.
(2)将称好的邻苯二甲酸氢钾放于锥形瓶中,加适量水溶解,溶液无色,再加入指示剂(从甲基橙、酚酞、石蕊中选择)1~2滴,用NaOH溶液滴定至终点时的现象是
。
(3)该学生进行三次实验,所取固体质量均相同,所需氢氧化钠溶液的体积如下表:
| 实验编号 | NaOH溶液的体积(mL) |
| 1 | 18.2 |
| 2 | 17.1 |
| 3 | 16.9 |
滴定中误差较大的是第 次实验;造成NaOH溶液体积偏大误差的原因不可能有(填序号) 。
①未用氢氧化钠溶液洗涤滴定管②滴定前平视,滴定后俯视 ③滴定前滴定管尖嘴处有气泡,滴定后气泡消失 ④滴定前,锥形瓶用邻苯二甲酸氢钾溶液润洗
(4)NaOH溶液的物质的量浓度为(只列出计算式,不必求出结果) mol/L。
题号
1
2
3
4
5
6
7
8
答案
A
A
D
B
B
C
B
D
题号
9
10
11
12
13
14
答案
C
BD
B
AC
CD
BC
三、(本题包括1小题,共10分)
15.(10分)
(1)量筒(1分) 22.80(写22.8不得分)(1分)
(2)①0.6(1分) ②酚酞(1分) 无色溶液变成浅红色,且半分钟内不褪色(2分)
③c(NaOH)= (2分)
(2分)
④B(2分)
四、(本题包括1小题,共12分)
16.(每空均2分,共12分)
(1)B (2)D (3)B、A (4)ABCD
(5)①Cu+H2SO4+H2O2=CuSO4+2H2O;
②H2O2 +

 +H2O;
+H2O;
五、(本题包括2小题,共18分)
17、(10分)
(1)2Fe2++Cl2=2Fe3+(2分) H2(g)+Cl2(g)=2HCl(g) ΔH= -184.6kJ/mol(2分)
 |
 (2)
(2分) 4NH3+5 O2====4NO
+6H2O(2分)
(2)
(2分) 4NH3+5 O2====4NO
+6H2O(2分)
|