
题目列表(包括答案和解析)
| O | - 4 |
| ||
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-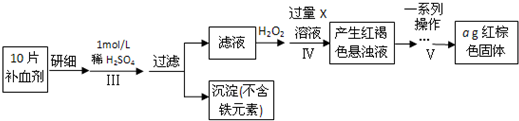
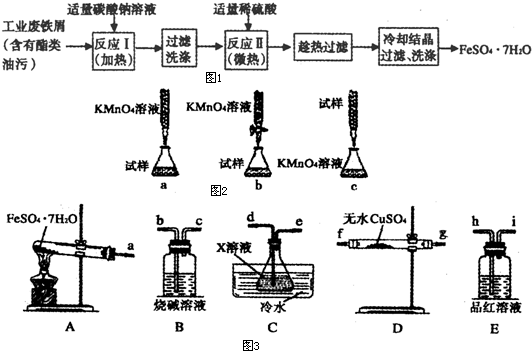
(14分) FeSO4•7H2O广泛用于医药和工业领域。
以下是FeSO4•7H2O的实验室制备流程图。根据题意完成下列填空:
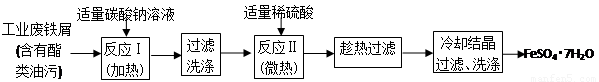
(1)碳酸钠溶液能除去酯类油污,是因为 (用离子方程式表示),反应Ⅰ需要加热数分钟,其原因是 。
(2)废铁屑中含氧化铁,无需在制备前除去,理由是(用离子方程式回答) , 。
(3)判断反应Ⅱ完成的现象是: , 。
以下是测定某补血剂(FeSO4•7H2O)中铁元素含量的流程图。根据题意完成下列填空:
|
 (4)、步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及 。写出步骤Ⅳ的离子方程式:
。
(4)、步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及 。写出步骤Ⅳ的离子方程式:
。
(5)步骤Ⅴ一系列操作依次是:①过滤②洗涤③ ④冷却⑤称量⑥恒重操作。操作⑥的目的是 。
(6)假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
(14分) FeSO4?7H2O广泛用于医药和工业领域。
以下是FeSO4?7H2O的实验室制备流程图。根据题意完成下列填空: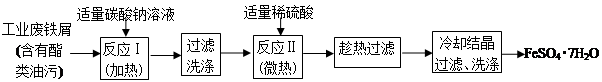
(1)碳酸钠溶液能除去酯类油污,是因为 (用离子方程式表示),反应Ⅰ需要加热数分钟,其原因是 。
(2)废铁屑中含氧化铁,无需在制备前除去,理由是(用离子方程式回答) , 。
(3)判断反应Ⅱ完成的现象是: , 。
以下是测定某补血剂(FeSO4?7H2O)中铁元素含量的流程图。根据题意完成下列填空:
|
 (4)、步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及 。写出步骤Ⅳ的离子方程式: 。(5)步骤Ⅴ一系列操作依次是:①过滤②洗涤③ ④冷却⑤称量⑥恒重操作。操作⑥的目的是 。
(4)、步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及 。写出步骤Ⅳ的离子方程式: 。(5)步骤Ⅴ一系列操作依次是:①过滤②洗涤③ ④冷却⑤称量⑥恒重操作。操作⑥的目的是 。(17分) FeSO4•7H2O广泛用于医药和工业领域。
以下是FeSO4•7H2O的实验室制备流程图。
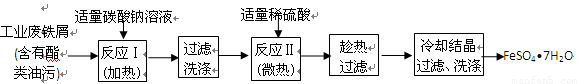
根据题意完成下列填空:
(1)碳酸钠溶液能除去酯类油污,是因为 (用离子方程式表示),反应Ⅰ需要加热数分钟,其原因是 。
(2)废铁屑中含氧化铁,无需在制备前除去,理由是
(用离子方程式回答) , 。
(3)判断反应Ⅱ完成的现象是: 。
以下是测定某补血剂(FeSO4•7H2O)中铁元素含量的流程图。根据题意完成下列填空:

(4)步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及 。写出步骤Ⅳ的离子方程式: 。
(5)步骤Ⅴ一系列操作依次是:①过滤②洗涤③ ④冷却⑤称量⑥恒重操作。操作⑥的目的是 。
(6)假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com