Ⅰ氮元素的化合物在现在以及将来有着广阔的发展前景
(1)氮化铝具有耐高温,抗冲击等优良性能,可以通过氧化铝、氮气和碳在高温下反应制得,缺点是会生成一种有毒气体,写出反应方程式:
,上述反应,每生成2mol氮化铝,N
2得到
mol电子.
(2)C
3N
4晶体的硬度可以和金刚石相媲美,且原子间均以单键结合,C
3N
4属于晶体,晶体中C-N键键长
金刚石中的C-C键键长(填“大于”、“小于”或“等于”).
(3)氮化硅是一种高温陶瓷材料,用来制作汽轮机叶子或永久性模具,现利用四氯化硅和氮气在氢气的作用下加强热,可得较高纯度的氮化硅,反应的化学方程式为:
,氮化硅抗腐蚀性强,但是易被氢氟酸腐蚀,写出相关的方程式
.
(4)氮的另外一种化合物肼(N
2H
4)是一种火箭发射原料,已知0.4mol液态肼与足量液态双氧水发生反应生成N
2和水蒸气,放出256.65kJ的热量.请写出该反应的热化学方程式:
.利用肼、氧气与KOH溶液可组成碱性燃料电池,肼分子(N
2H
4)可以在氧气中燃烧生成氮气和水.则该电池反应的负极反应式为:
;电池工作时,电解质溶液中的OH
-离子向
极移动.
Ⅱ用地壳中某主要元素生产的多种产品在现代高科技中占重要位置,足见化学对现代物质文明的重要作用.例如:
(1)目前应用最多的太阳能电池的光电转化材料是
;
(2)光导纤维的主要成分是:
(3)用作吸附剂、干燥剂、催化剂或催化剂载体的人造分子筛大多是一类称为
的化合物.

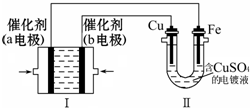 如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),电池总反应为:CH4+2O2+2KOH=K2CO3+3H2O,通过装置Ⅱ实现铁棒上镀铜.下列说法正确的是( )
如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),电池总反应为:CH4+2O2+2KOH=K2CO3+3H2O,通过装置Ⅱ实现铁棒上镀铜.下列说法正确的是( )