
题目列表(包括答案和解析)
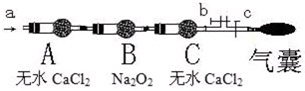

 N2O4;△H<0) (如下图)
N2O4;△H<0) (如下图)
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA_________VB。(填“>”.“<”.“=”);若打开活塞K2,气球B将__________(填:变大、变小、不变)。
(2)若在A、B中再充人与初始量相等的NO2,则达到平衡时,NO2的转化率αA将_________ (填增大或减小.不变);若通人等量的Ne气,则达到平衡时,A中NO2的转化率将_________,B中NO2的转化率将_________(填: 变大、变小、不变)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,_________中的颜色较深。
(4)若在容器A中充人4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为_________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com