
题目列表(包括答案和解析)
某天然碱的化学组成可能为aNa2CO3?bNaHCO3?cH2O (a、b、c为正整数),
为确定其组成,化学兴趣小组的同学进行了如下实验:
(1)定性分析:
①取少量天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝。能否说明样品中含结晶水,试简述理由。
②请你设计一个简单的实验方案,确认样品中含有CO32―离子。
(2)定量分析:该小组同学设计了下图所示装置,测定天然碱的化学组成。
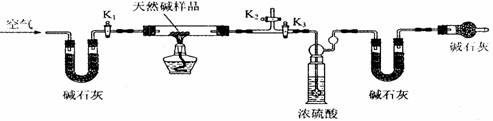
A B C D E
实验步骤:
①按上图(夹持仪器未画出)组装好实验装置后,首先进行的操作是 。
A处碱石灰的作用是 E处碱石灰的作用是
。
②称取天然碱样品7.3g,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶的质量为87.6g,装碱石灰的U型管D的质量为74.7g。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热,待不再产生气体为止。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后称得装浓硫酸的洗气瓶质量为88.5g;装碱石灰的U型管D的质量为75.8g。该步骤中缓缓鼓入空气数分钟的目的是
。计算推导:该天然碱的化学式为 。
(1)某硫酸厂每天排放的1万米3尾气中含0.2%(体积百分数)的SO2。问用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少kg石膏(CaSO4×2H2O )。
(2)如果将一定体积的尾气通入100mL 2mol/L的氢氧化钠溶液使其完全反应,经测定所得溶液含16.7g溶质。试分析该溶液的成分,并计算确定各成分的物质的量。
(3)工厂在尾气处理制石膏的过程中,中间产物是亚硫酸氢钠。调节尾气排放的流量,以取得二氧化硫与氢氧化钠间物质的量的最佳比值,从而提高亚硫酸氢钠的产量。
现设![]() ,nNaOH,
,nNaOH,![]() 分别表示二氧化硫、氢氧化钠和亚硫酸氢钠的物质的量,且
分别表示二氧化硫、氢氧化钠和亚硫酸氢钠的物质的量,且![]() ,试写出X在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2),nNaOH间的关系式。
,试写出X在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2),nNaOH间的关系式。
X ![]()
接触法制硫酸排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前设法进行综合利用。
(1)某硫酸厂每天排放的1万米3尾气中含0.2%(体积百分数)的SO2。问用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少kg石膏(CaSO4×2H2O )。
(2)如果将一定体积的尾气通入100mL 2mol/L的氢氧化钠溶液使其完全反应,经测定所得溶液含16.7g溶质。试分析该溶液的成分,并计算确定各成分的物质的量。
(3)工厂在尾气处理制石膏的过程中,中间产物是亚硫酸氢钠。调节尾气排放的流量,以取得二氧化硫与氢氧化钠间物质的量的最佳比值,从而提高亚硫酸氢钠的产量。
现设![]() ,nNaOH,
,nNaOH,![]() 分别表示二氧化硫、氢氧化钠和亚硫酸氢钠的物质的量,且
分别表示二氧化硫、氢氧化钠和亚硫酸氢钠的物质的量,且![]() ,试写出X在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2),nNaOH间的关系式。
,试写出X在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2),nNaOH间的关系式。
X ![]()
(18分)(1)标准状况下,44.8L的NH3气体质量为 g,其中含 个氮原子,其中含 mol 氢原子。
(2)标准状况下,11.2L的H2R气体质量为17g,则H2R的摩尔质量是 ,等质量的NH3与H2R的物质的量比为 ,1.7g氨气与 mol H2O含有的电子数相等。
(3)过氧化钠几乎可与所有的常见气态非金属氧化物反应。如:
2Na2O2 +2CO2 = 2Na2CO3 + O2 ; Na2O2 +CO = Na2CO3
试分别写出Na2O2与SO2、SO3反应的化学方程式:
(4)取黄豆粒大小的一块金属钠,用滤纸擦干其表面的煤油,然后加入到硫酸铜溶液中,观察实验现象并写出相关的化学方程式:
①实验现象
②有关的化学方程式是 。
。
(18分)(1)标准状况下,44.8L的NH3气体质量为 g,其中含 个氮原子,其中含 mol 氢原子。
(2)标准状况下,11.2L的H2R气体质 量为17g,则H2R的摩尔质量是 ,等质量的NH3与H2R的物质的量比为 ,1.7g氨气与 mol H2O含有的电子数相等。
量为17g,则H2R的摩尔质量是 ,等质量的NH3与H2R的物质的量比为 ,1.7g氨气与 mol H2O含有的电子数相等。
(3)过氧化钠几乎可与所有的常见气态非金属氧化物反应。如:
2Na2O2 + 2CO2 = 2Na2CO3 + O2 ; Na2O2 + CO = Na2CO3
试分别写出Na2O2与SO2、SO3反应的化学方程式:
(4)取黄豆粒大小的一块金属钠,用滤纸擦干其表面的煤油,然后加入到硫酸铜溶液中,观察实验现象并写出相关的化学方程式:
①实验现象 

②有关的化学方程式是 。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com