
题目列表(包括答案和解析)
(9分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,也可用NH3处理,也可用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下2.24L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
(2)已知:2SO2(g)+O2(g) 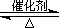 2SO3(g) ?H="-196.6" kJ·mol-1
2SO3(g) ?H="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ?H="-113.0" kJ·mol-1
2NO2(g) ?H="-113.0" kJ·mol-1
(ⅰ)则反应NO2(g)+SO2(g) SO3(g)+NO(g)的?H= kJ·mol-1。
SO3(g)+NO(g)的?H= kJ·mol-1。
(ⅱ)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
A.每消耗1 mol SO3的同时生成1 mol NO2 B. 体系压强保持不变
C. 混合气体颜色保持不变 D. SO3和NO的体积比保持不变
(ⅲ)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图(左)所示。平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)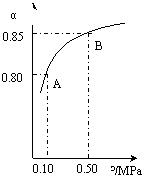
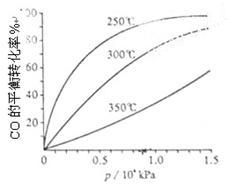
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。
(9分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,也可用NH3处理,也可用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下2.24L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
(2)已知:2SO2(g)+O2(g)
 2SO3(g) ?H="-196.6"
kJ·mol-1
2SO3(g) ?H="-196.6"
kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ?H="-113.0"
kJ·mol-1
2NO2(g) ?H="-113.0"
kJ·mol-1
(ⅰ)则反应NO2(g)+SO2(g) SO3(g)+NO(g)的?H= kJ·mol-1。
SO3(g)+NO(g)的?H= kJ·mol-1。
(ⅱ)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
A.每消耗1 mol SO3的同时生成1 mol NO2 B. 体系压强保持不变
C. 混合气体颜色保持不变 D. SO3和NO的体积比保持不变
(ⅲ)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图(左)所示。平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)


(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。
研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示) 。
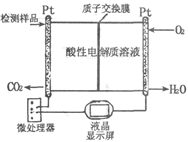
(2)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式:
负极 ,正极 。
(3)一定条件下,NO2和SO2反应生成SO3(g)和NO两种气体,现将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。(填序号)
| A.体系压强保持不变 | B.混合气体颜色保持不变 |
| C.SO3、NO的体积比保持不变 | D.每消耗 1 mol SO2,同时生成1 mol NO |
研究NO2.SO2.CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,也可用NH3处理,也可用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下2.24L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
(2)已知:2SO2(g)+O2(g) 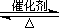 2SO3(g) ?H=-196.6 kJ·mol-1
2SO3(g) ?H=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ?H=-113.0 kJ·mol-1
2NO2(g) ?H=-113.0 kJ·mol-1
(ⅰ)则反应NO2(g)+SO2 (g) SO3(g)+NO(g)的?H= kJ·mol-1。
SO3(g)+NO(g)的?H= kJ·mol-1。
(ⅱ)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
A.每消耗1 mol SO3的同时生成1 mol NO2 B.体系压强保持不变
C.混合气体颜色保持不变 D. SO3和NO的体积比保持不变
(ⅲ)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图(左)所示。
平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”.“<”或“=”)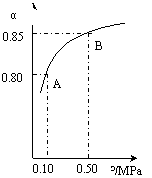
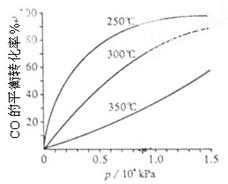
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。
| A.体系压强保持不变 | B.混合气体颜色保持不变 |
| C.SO3、NO的体积比保持不变 | D.每消耗 1 mol SO2,同时生成1 mol NO |
Ⅰ卷(共50分)
A卷
一、单项选择题(每小题2分,共20分)
1.B 2.C 3.C 4.B 5.B 6.D 7.B 8.D 9.C 10.D
二、单项选择题(每小题3分,共30分)
11.B 12.D 13.B 14.D 15.D 16.C 17.D 18.A 19.B 20.D
B卷
一、单项选择题(每小题2分,共20分)
1.B 2.C 3.C 4.B 5.C 6.D 7.B 8.D 9.B 10.D
二、单项选择题(每小题3分,共30分)
11.C 12.D 13.B 14.D 15.D 16.B 17.D 18.A 19.C 20.D
Ⅱ卷(共60分)
21.(8分)
(1)0.2 mol(2分)
(2)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O(2分)
CO2↑+2SO2↑+2H2O(2分)
(3)NH4++HCO3-+2OH- NH3↑+CO32-+2H2O(2分,其它合理答案同样给分)
NH3↑+CO32-+2H2O(2分,其它合理答案同样给分)
NH4++HSO3-+2OH- NH3↑+SO32-+2H2O
NH3↑+SO32-+2H2O
NH4++HS-+2OH- NH3↑+S2-+2H2O
NH3↑+S2-+2H2O
(4)4H++AlO2-===Al3++2H2O(2分)
22.(8分)
(1)N2H4 (1)+O2(g)=N2(g)+2H2O(l);△H=-624kJ/mol (2分)
(2) N2H4+4OH--4e-=4H2O+N2↑ (2分)
(3)①Cu2++2e-=Cu (1分) ②112 (1分)
(4)ClO-+2NH3=N2H4+Cl-+ H2O (2分)
23.(共6分,每小题2分)
(1)A: G:HCOOCH3
G:HCOOCH3
(2)①⑤ (漏选不给分)
(3)B→D:

24.(共10分,每小题2分)
(1)醛基、碳碳双键 (注:只答双键不给分;错答、漏答均不给分)

(2)bc (漏选不给分)
(3)
(4)4
(5)CD;CF (漏选不给分)
25.(4分)①⑥(选对一个得2分,选对两个得4分,只要有错的就不得分)
26.(13分)(每空1分)
(1)带导管的单孔塞
CH3CHO
+ 2Cu(OH)2 CH3COOH + Cu2O↓ + 2H2O
CH3COOH + Cu2O↓ + 2H2O
(2)C 饱和碳酸钠溶液 碎瓷片(或玻璃片等)
(3)AD 品红(答案合理即可) c
(4)ABE ④②①③
 2CH3CH2OH+O2
Cu △ 2CH3CHO +H2O
2CH3CH2OH+O2
Cu △ 2CH3CHO +H2O
(5)否 浓硝酸与铜反不需要加热 ,且浓硝酸受热分解(答案合理即可)
27.(4分)
(1) (2分)
(2分)
(2)1:1(2分)
28.(7分)
(1) (2分)
(2分)
(2) (2分)
(2分)
(3) (1分)
b=0.12mol (2分)
(1分)
b=0.12mol (2分)
解析



故总耗HNO3量
(也可以将金属混合物看成是一种,按照3M~8HNO3计算硝酸的最大量)
所以
(3)
根据电子守恒:

又知: 

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com