
题目列表(包括答案和解析)
已知298k时,合成氨反应N2(g)+3H2(g) ![]() 2NH3(g);ΔH=-92.0kJ·mol-1,将此温度下的1mol N2和3mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)( )
2NH3(g);ΔH=-92.0kJ·mol-1,将此温度下的1mol N2和3mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)( )
A.一定大于92.0kJ B.一定小于92.0kJ
C.一定等于92.0kJ D.无法确定
298K时,有两只容积相等的密闭容器A和B,A容器保持恒容,B容器保持恒压。起始时,向A容器充入3molH2和1molN2,向B容器充入3molH2和2molN2,发生如下反应:
N2(g)+3H2(g)![]() 2NH3(g)。已知298K时,
2NH3(g)。已知298K时,![]() H=-92.4kJ?mol-1,
H=-92.4kJ?mol-1,![]() S=-198.2J?mol-1?K-1
S=-198.2J?mol-1?K-1
请回答下列问题:
(1)根据反应的焓变和熵变计算分析298K下合成氨反应能自发进行(列出计算式即可)
(2)达平衡后,若向两容器中通入与起始时等量的原反应气体,达到新的平衡时,A容器中NH3的体积分数 (填“增大”、“减小”或“不变”,下同),B容器中的NH3的体积分数
(3)298K时,将NH3通入水中得到0.1mol?L-1的氨水,测定其pH约为11,向其中加入少量的NH4Cl晶体,晶体溶解后发现溶液的pH减小。对于上述现象有两种不同的解释:
甲观点:NH4Cl水解呈酸性,增大c(H+),因此溶液的pH减小。
乙观点:NH4Cl溶于水电离出大量的NH4+,抑制NH3?H2O的电离,使c(OH-)减小,因此溶液的pH减小。
请你设计一个简单实验进行验证上述观点哪个正确,试剂自选。
(提示:298K时,0.1mol?L-1的NH3?H2O和CH3COOH的电离常数均为1.75×10-5)
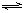 2NH3(g)ΔH=-92.2kJ?mol-1 ΔS=-198.2J?mol-1?K-1。
2NH3(g)ΔH=-92.2kJ?mol-1 ΔS=-198.2J?mol-1?K-1。
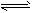 2NH3(g) 已知298K时:正反应的△H=-92.4KJ/mol,△S=-198.2J/mol/K。
2NH3(g) 已知298K时:正反应的△H=-92.4KJ/mol,△S=-198.2J/mol/K。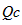 )
)1、D 2、C 3、A 4、B 5、B 6、B 7、C 8、B 9、BD 10、AC
11、CD 12、AD 13、A 14、AB 15、B 16、AC
17.(4分)(1)⑦(2分)(2)④⑥(2分)
18.略
19.(2)将灰烬转到烧杯中,加适量蒸馏水,用玻璃棒充分搅拌,煮沸,过滤(4分)
(3)D(2分)
过氧化氢是绿色氧化剂,在氧化过程中不会引进杂质、不产生污染。氧化性适中。(2分)
20.⑴2Cu+O2.files/image024.gif) 2CuO CH3CH2OH+CuO
2CuO CH3CH2OH+CuO.files/image026.gif) CH3CHO+Cu+H2O 放热
CH3CHO+Cu+H2O 放热
⑵加热 冷却 ⑶乙酸 c 蒸馏
21.KIO3 ① SO32-
22.(1)该反应放出的热量使铁熔化,而铝的熔点比铁低,此时未反应的铝和铁熔合形成铁铝合金。2分(2)NaOH溶液2分,块状熔融物表面有无色气泡放出2分(3)B (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com