
题目列表(包括答案和解析)
(本题共14分)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。请回答下列问题:


(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)已知在450℃并有催化剂存在下:2 SO2 (g)+O2(g)
 2SO3(g)
△H = -196.6 KJ·mol- 1,
2SO3(g)
△H = -196.6 KJ·mol- 1,
①该热化学反应方程式的意义是 。
②图1中的ΔH2 = KJ·mol-1
③恒温恒容时,1molSO2和2molO 2 充分反应,放出热量的数值比∣ΔH2 ∣ (填“大”“小”或“相等”)
④)恒容条件下,下列措施中能使n(SO3)/ n(SO2 )增大的有 。
a.升高温度 b.充入He气
c.再充入1molSO2 (g)和1molO 2 (g) d.使用催化剂
(3) 某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率 与时间t的关系如图2所示,若不改变SO2 (g)和O 2 (g)的量,则:
与时间t的关系如图2所示,若不改变SO2 (g)和O 2 (g)的量,则:
①图中t4时引起平衡移动的条件可能是 ;
②图中表示平衡混合物中SO3的含量最高的一段时间是____________。
A、t1~t2 B、t3~t4 C、t5~t6 D、t7~t8
(本题共14分)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。请回答下列问题:

(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)已知在450℃并有催化剂存在下:2 SO2 (g)+O2(g)  2SO3(g) △H = -196.6 KJ·mol-1,
2SO3(g) △H = -196.6 KJ·mol-1,
①该热化学反应方程式的意义是 。
②图1中的ΔH2 = KJ·mol-1
③恒温恒容时,1molSO2和2molO 2充分反应,放出热量的数值比∣ΔH2 ∣ (填“大”“小”或“相等”)
④)恒容条件下,下列措施中能使n(SO3)/ n(SO2 )增大的有 。
a.升高温度 b.充入He气
c.再充入1molSO2 (g)和1molO 2 (g) d.使用催化剂
(3) 某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率 与时间t的关系如图2所示,若不改变SO2 (g)和O 2 (g)的量,则:
与时间t的关系如图2所示,若不改变SO2 (g)和O 2 (g)的量,则:
①图中t4时引起平衡移动的条件可能是 ;
②图中表示平衡混合物中SO3的含量最高的一段时间是____________。
| A.t1~t2 | B.t3~t4 | C.t5~t6 | D.t7~t8 |
氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列的研究
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同。
已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH = -483.6 kJ/mol
3H2 (g) + N2 (g)  2NH3 (g) ΔH =
-92.4 kJ/mol
2NH3 (g) ΔH =
-92.4 kJ/mol
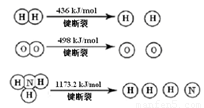
计算断裂1 mol N≡N键需要能量 kJ , 氮气分子中化学键比氧气分子中的化学键键 (填“强”或“弱”),因此氢气与二者反应的条件不同。
(2)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:N2 (g) + O2 (g) = 2NO (g) ΔH = +180.8 kJ/mol ,工业合成氨则是人工固氮。
分析两种固氮反应的平衡常数,下列结论正确的是 。
|
反应 |
大气固氮 |
工业固氮 |
||||
|
温度/℃ |
27 |
2000 |
25 |
350 |
400 |
450 |
|
K |
3.84×10-31 |
0.1 |
5×108 |
1.847 |
0.507 |
0.152 |
A.常温下,大气固氮几乎不可能进行,而工业固氮非常容易进行
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
(3)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料, 发生反应:3H2
(g) + N2 (g)  2NH3
(g)测得甲容器中H2的转化率为40%。
2NH3
(g)测得甲容器中H2的转化率为40%。
|
|
N2 |
H2 |
NH3 |
|
甲 |
1 |
3 |
0 |
|
乙 |
0.5 |
1.5 |
1 |
|
丙 |
0 |
0 |
4 |
判断乙容器中反应进行的方向 。(填“正向”或“逆向”)
达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为 。
(4)氨气是合成硝酸的原料,写出氨气与氧气反应生成一氧化氮和气态水的热化学方程式 。
氨气是生产化肥、硝酸的重要原料,围绕合成氨人们进行了一系列的研究
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同。
已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH =" -483.6" kJ/mol
3H2 (g) + N2 (g)  2NH3 (g) ΔH =" -92.4"
kJ/mol
2NH3 (g) ΔH =" -92.4"
kJ/mol

计算断裂1 mol N≡N键需要能量 kJ , 氮气分子中化学键比氧气分子中的 化学键键 (填“强”或“弱”),
(2)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:
N2 (g) + O2 (g) =" 2NO" (g) ΔH =" +180.8" kJ/mol ,工业合成氨则是人工固氮。
分析两种固氮反应的平衡常数,下列结论正确的是 。
|
反应 |
大气固氮 |
工业固氮 |
||||
|
温度/℃ |
27 |
2000 |
25 |
350 |
400 |
450 |
|
K |
3.84×10-31 |
0.1 |
5×108 |
1.847 |
0.507 |
0.152 |
A.常温下,大气固氮几乎不可能进行,而工业固氮非常容易进行
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
(3)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料, 发生反应:
3H2 (g) + N2 (g)  2NH3 (g)测得甲容器中H2的转化率为40%。
2NH3 (g)测得甲容器中H2的转化率为40%。
|
|
N2 |
H2 |
NH3 |
|
甲 |
1 |
3 |
0 |
|
乙 |
0.5 |
1.5 |
1 |
|
丙 |
0 |
0 |
4 |
①判断乙容器中反应进行的方向 。(填“正向”或“逆向”)
②达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为 。
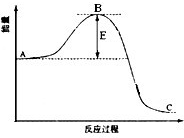 合成氨反应过程中的能量变化如图所示,据图回答下列问题:
合成氨反应过程中的能量变化如图所示,据图回答下列问题:| [NH3]2 |
| [N2][H2]3 |
| [NH3]2 |
| [N2][H2]3 |
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的浓度(mol?L-1) | c1 | c2 | c3 |
| 反应物转化率 | a1 | a2 | a3 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com