
题目列表(包括答案和解析)
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (K) |
7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
 ,下列说法正确的是
,下列说法正确的是 SO2Cl2(l)△H=-97.3kJ?mol-1
SO2Cl2(l)△H=-97.3kJ?mol-1(16分)
(1)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl+S +SO2。请回答下列问题:
①电池的负极材料为 ,发生 反应(填“氧化”或“还原”)。
② SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,反应的化学方程式为 ;
(2)过度排放CO会造成“温室效应”,科学家正在研究如何将CO转化为可以利用的资源,其中一种方案就是将CO转化为可再生燃料甲醇(CHOH)。其化学方程式为:CO2(g)+3H2(g) CH3OH(g)+ H2 O(g),请填空:
①写出上述反应的平衡常数表达式K:_________________
②选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此燃料电池负极应加入或通入的物质是
③25℃,1.01×10Pa时16 g液态甲醇完全燃烧,当恢复至原状态时,放出362.9 kJ热量,此反应的热化学方程式为______________________________.
Ⅰ.电离平衡常数(用K表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
|
化学式 |
HF |
H2CO3 |
HClO |
|
电离平衡常数 (K) |
7.2×10-4 |
K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的下列四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是______________。
(2)25℃时,在20mL0.1mol·L—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_______。

A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol·L—1
(3)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-akJ·mol—1,
②H+(aq)+OH-(aq)=H2O(l) ΔH=-bkJ·mol—1,
氢氟酸的电离方程式及热效应可表示为________________________。
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与等物质的量的H2O反应得到HF和化合物A,则每生成1molHF转移_______mol电子。
Ⅱ.氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点–54.1℃,沸点69.1℃。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
SO2(g)+Cl2(g) SO2Cl2(l) △H=–97.3kJ·mol—1
SO2Cl2(l) △H=–97.3kJ·mol—1
(1)试写出常温常压下化学平衡常数K的表达式:K=_________________;
(2)对上述反应,若要使化学平衡常数K增大,化学反应速率v正也增大,可采取的措施是_____(选填编号)。
a.降低温度 b.移走SO2Cl2
c.增加反应物浓度 d.无法满足上述条件
(3)下列描述中能说明上述反应已达平衡的是____________(选填编号)。
a.υ(Cl 2)=υ(SO2) b.容器中气体压强不随时间而变化
c.c(Cl 2) : c(SO2)=1:1 d.容器中气体颜色不随时间两变化
(4)300℃时,体积为1L的密闭容器中充入16.20g SO2Cl2,达到平衡时容器中含SO2 7.616g。若在上述中的平衡体系中,再加入16.20g SO2Cl2,当再次达平衡时,容器中含SO2的质量范围是________________________。
(16分)
(1)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl+S +SO2。请回答下列问题:
①电池的负极材料为 ,发生 反应(填“氧化”或“还原”)。
② SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,反应的化学方程式为 ;
(2)过度排放CO会造成“温室效应”,科学家正在研究如何将CO转化为可以利用的资源,其中一种方案就是将CO转化为可再生燃料甲醇(CHOH)。其化学方程式为:CO2(g)
+3H2(g) 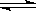 CH3OH(g)
+ H2 O(g),请填空:
CH3OH(g)
+ H2 O(g),请填空:
①写出上述反应的平衡常数表达式K:_________________
②选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此燃料电池负极应加入或通入的物质是
③25℃,1.01×10Pa时16 g液态甲醇完全燃烧,当恢复至原状态时,放出362.9 kJ热量,此反应的热化学方程式为______________________________.
本卷分第1卷(选择题)和第1I卷。
第Ⅰ卷共18题,每小题6分,共108分。
一、选择题:选对的给6分,选错或未选的给0分。
1.D 2.A 3.C 4.D 5.B 6.D
7.D 8.C 9.B 10.C 11.D 1 2.B
二、选择题:全部选州的给6分,选对但不全的给3分,有选错或未选的给0分。
13.B 14.AB 15.D 16.C 17.C 18.CD
 第Ⅱ卷必考部分共9题,共157分。
第Ⅱ卷必考部分共9题,共157分。
19.(18分)
(1) CE (4分)
(2) ①如右图所示(6分)
②1 500(4分) 0.90(4分)
20.(15分)
解:设甲车刹下后经时间t,甲、乙两车速度相等,则:
 ①
①
 ②
②
 ③
③
 ④
④
 ⑤
⑤
联立以上各式得:

21.(19分)
解:一个运动周期时间为4秒,、半个周期t=2秒
物体所受到的摩擦力大小为: 
前2秒内物体的加速度: 
2―4秒物体的加速度:

前4秒的位移大小: 
第84秒的位移 
83抄时的速度 
83.秒内的位移大小:

83.秒内外力F对物体做的功为:

22.(20分)
解:
(1) 设带电粒子在磁场中做匀速圆周运动的半径为R、周期为T,带电粒子在磁场中做匀速圆周运动,洛伦兹力提供向心力,有  (2分)
(2分)
而周期  (2分)
(2分)
由以上两式可得 (2分)
(2分)
说明带电粒子在磁场中做匀速圆周运动的周期与磁场方向变化的周期
相等,当带电粒子运动在PQ直线时,磁场反向,只要PQ之间的距离

 时,带电粒子均能到达Q点与中性粒子相碰撞,所以
时,带电粒子均能到达Q点与中性粒子相碰撞,所以  (2分)
(2分)
即 (2分)
(2分)
同时有 
 (2分)
(2分)
当 200V时,
200V时, =3,带电粒子能与中性粒子相碰撞。 (1分)
=3,带电粒子能与中性粒子相碰撞。 (1分)
(2)如右上图(3分)
(3)能使带电粒子与中性粒子碰撞,加速电压的最大值由  可知,当
可知,当  时,即
时,即 450V
(4分)
450V
(4分)
23.(20分)
(1)  (4分)
(4分)
(2) ①>②>④>③ 6×10-10 (每空2分,共4分)
(3) 10.6 100ml容量瓶 (每空2分,共4分)
(4)① (2分)
(2分)
② 反应② 废弃物利用, 有利于环保(合理即可)(每空2分,共4分)
③ ①减小. ②有利 (每空2分,共4分)
24.(10分)
(1)  (2分)
(2分)
(2)  (2分)
(2分)
(3) 
H-放电促进了水的电离OH-浓度增大 B (每空2分,共6分)
25.(15分)
(1) 向色固体变黑色; (2分)
(2) 测量生成氧气的体积; (2分)
(3) 不正确。因为氧气也能与B中的溶液发生反应; (3分)
(4) 没必要。因为气体通过E后,又混入了水分; (3分)
(5) 二氧化硫为0.02mol,三氧化硫为0.01mol; (每空1分,共2分)
 (3分)
(3分)
26.(26分)
I (8分)
(1) 不理想,因为该细胞叶绿体中含有颜色较深的叶绿素等色素,鉴定时对颜色反应
起着干扰作用。 (3分)
 (2) (3分)
(2) (3分)
(3) ①(2分)
II(18分)
(1)9 4 (4分)
(2) 按种相应的病原体 全部感病(或非糯感病)HHrr
抗病和感病(或非糯抗病和非糯感病) HHRR、HHRr、HHrr (10分)
(3) 基因突变 HHRr (4分)
27.(14分)
(1) 染色体的运动是由于纺锤丝的牵引
(4) ①分裂期②染色体的运动情况
(5) ①其一是,该实验要观察活细胞染色体的运动,不能解离和漂洗:其二是,缺少对照组,应添加一组不加秋水仙素的对照组。
②A.滴加一定浓度的秋水仙素溶液,能抑制纺锤体形成,染色体将不再运动,说明染色体的运动是由于纺锤丝的牵引;
B.滴加一定浓度的秋水仙素溶液,能抑制纺锤体形成,染色体仍能运动,说明染色体的运动不是由于纺锤丝的牵引。
第1I卷选考部分共5题,共35分。其中,第28、29题为物理题,第30、
为化学题,考生从两道物理题、两道化学题中各任选一题做答,若第28、29题
都作答,则按第28题计分,若第30、31题都作答,则按第30题计分,第32题
为生物题,是必答题。
28.(12分)
(1) ③ (2) ② (各6分,共12分)
29.(12分)
(1) ③ (2) ④ (各6分,共12分)
30.(13分)(1) 4(2分) 8(2分)XY2(或Y2X) (3分)
(2) 12 (3分)
(3)
31.(13分)
(1) C9Hl00 消去反应(再2分) (2)HCOOH,
 (各3分)
(各3分)
32.(10分)
(1) 限制酶、DNA连接酶 显微注射法
(2) 胚胎分割移植(胚胎分割和胚胎移植)
(3) 全能性高 植物组织培养
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com