
题目列表(包括答案和解析)
化学实验是研究物质性质的基础.
(1)下列有关实验操作或测量数据合理的是________(填序号).
a.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20 mL的量筒,量取16.8 mL的Na2CO3溶液
(2)某废水样品中含有一定的Na+、CO32-、SO32-,甲、乙两研究小组欲测定其中SO32-离子的浓度.
![]()
甲组方案:
试剂X从下列试剂中选择:
a.0.1 mol·L-1 KMnO4(H2SO4酸化)溶液
b.0.5 mol·L-1 NaOH溶液
c.新制氯水d.KI溶液
①加入的试剂X为________(填字母序号),生成SO42-主要的离子方程式为________.
②甲组方案中,第ⅲ步的“系列操作”包含的操作名称各为________.
乙组方案:
ⅰ.用烧杯盛取废水适量,加少量活性炭,除去废水的杂色;过滤,取滤液;
ⅱ.精确量取20.00 mL过滤后废水试样,选择使用紫色的0.1 mol·L-1 KMnO4(H2SO4酸化)溶液进行滴定:(有关反应为:2MnO4-+5SO32-+6H+![]() 2Mn2++5SO42-+3H2O)
2Mn2++5SO42-+3H2O)
ⅲ.记录数据,计算.
③乙组设计的下列滴定方式中,最合理的是________(夹持部分略去)(填字母序号)
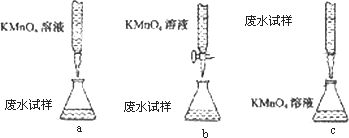
(3)某同学制备Fe(OH)3胶体:用洁净烧杯量取适量蒸馏水加热至沸腾,向烧杯中缓慢滴加饱和的FeCl3溶液,并不断用玻璃棒搅拦,结果溶液变浑浊.该同学制备胶体失败的原因是________,你认为成功制得Fe(OH)3胶体的特征现象是________.
(4)用下图装置进行CO2性质的有关实验.
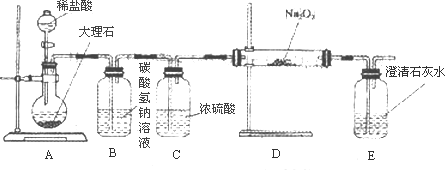
①试剂瓶B中盛有饱和NaHCO3溶液,其目的是________.
②反应过程中,E中澄清石灰水变浑浊,E中的混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系________.

(1)利用上述药品制NaOH溶液的化学方程式是____________________________。
(2)为制备NH3,可先从废干电池中制备NH4Cl。假设将废电池中的混合物溶于少量的水中,过滤除去不溶物,再蒸发滤液,并灼烧以制得干燥的NH4Cl晶体。你认为这一设想是否合理?答:____________,其理由是____________________________________。
(3)他们在进行除去淀粉溶液中食盐的实验时,用鸡蛋壳膜自制了一个半透膜小袋,向其中装入混有NaCl的淀粉溶液,扎好袋口,这一实验的操作名称为________________________。要保证全部除去淀粉溶液里的食盐,实验中必须____________________________________。
(4)由于实验(2)中NH4Cl的制备较困难,且难以满足量的要求,现重新提供足量的浓氨水、浓NaOH溶液和NH4Cl晶体,请设计一个最简单的实验,以快速制得NH3。
①你设计的实验方案是__________________________。
②请运用化学原理对你的方案予以解释_________________________________________。
实验室可用K2Cr2O7固体与浓盐酸混合加热制备氯气(K2Cr2O7被还原为Cr3+)。
(1)K2Cr2O7与浓盐酸反应的化学方程式为_______;若反应中转移3 mol e-,则消耗_______mol K2Cr2O7
(2)稀盐酸与K2Cr2O7固体混合加热没有氯气生成。为探究影响氯气生成的因素,某化学兴趣小组进行如下实验:
①提出假设
假设1:Cl-浓度对反应有影响;
假设2:H+浓度对反应有影响;
假设3: _____________________。
②设计实验方案,进行实验。写出实验步骤及预期现象和结论。
限选举实验试剂:浓盐酸、稀盐酸、浓硫酸、NaOH溶液、K2Cr2O7固体、NaCl固体、湿润的淀粉KI试纸
|
实验步骤 |
预期现象和结论 |
|
步:1:向盛有K2Cr2O7固体的A、B两试管中分别加入一定量的稀盐酸。 |
|
|
步骤2: |
|
|
步骤3: |
|
实验题(14分):Ⅰ、HCOOH是一种无色、易挥发的液体,某学习小组参照: 原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。
原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。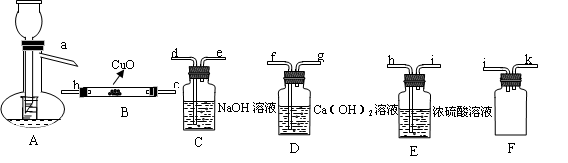
(1)若所制气体流向从左向右时,上述仪器连接为: A→( ) →( )→( )→( ) →( )
(2)A装置中小试管的作用(至少答两条):
① 。② 。
(3)证明HCOOH受热产物中有CO的现象为: 。
(4)本实验有3处用到酒精灯,除A、B处外,还缺一个酒精灯,应放在 处.
Ⅱ、学习小组查阅资料知:
Cu的颜色为红色或紫红色,而Cu2O的颜色也为红色或砖红色。②4CuO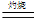 2 Cu2O + O2↑;③ Cu2O +2H+
2 Cu2O + O2↑;③ Cu2O +2H+
= Cu+Cu2+ + H2O ;因此对CO充分还原CuO后所得红色固体是否含有Cu2O进行了认真的研究,提出下列设计方案:
方案①:取该红色固体溶于足量稀硝酸中,观察溶液颜色的变化。
方案②:取该红色固体溶于足量稀硫酸中,观察溶液颜色的变化。
(5)写出Cu2O与稀硝酸反应的化学方程式: 。
(6)请你评价方案②的合理性,并简述理由:方案②: ,理由: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com