
题目列表(包括答案和解析)
A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大。A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4; G+的M层电子全充满。用化学式或化学符号回答下列问题:

(1)G的基态原子的外围电子排布式为 ,周期表中F属于 区。
(2)B与F形成的一种非极性分子的电子式为 ;F的一种具有强还原性的氧化物分子的VSEPR模型为
(3)BD2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于_______
(选填“分子”、“原子”、“离子”或“金属”)晶体
(4)设C元素的气态氢化物为甲,最高价氧化物的水化物为乙,甲与乙反应的产物为丙。常温下,有以下3种溶液:①pH=11的甲的水溶液 ②pH=3的乙的水溶液 ③pH=3的丙溶液,3种溶液中水电离出的cH+之比为
(5)丁、戊分别是E、F两种元素最高价含氧酸的钠盐,丁、戊溶液能发生反应。当丁、戊溶液以物质的量之比为1:4混合后,溶液中各离子浓度大小顺序为
(6)A和C形成的某种氯化物CA2Cl可作杀菌剂,其原理为CA2Cl遇水反应生成一种具有强氧化性的含氧酸,写出CA2Cl与水反应的化学方程式:___________________________
(7)往G的硫酸盐溶液中加入过量氨水,可生成一种配合物X,下列说法正确的是___ __
A.X中所含化学键有离子键、极性键和配位键
B.X中G2+给出孤对电子,NH3提供空轨道
C.组成X的元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为正四面体
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增。B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3P轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体。根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为 (用元素符号表示)。
(2)化合物BD3的分子空间构型是 。
(3)上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED),其材料是E与F形成的化合物甲(属于第三代半导体),用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%。化合物甲的晶胞结构如右图(白球代表F,黑球代表E)。试回答:
①该晶胞中所包含的F原子(白色球)个数为 。
②与同一个E原子相连的F原子构成的空间构型为 。
③下列说法正确的是 。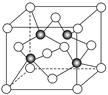
A.该晶胞结构与NaCl相同 B.半导体EB与EF互为等电子体
C.电负性:F>E D.EF晶体中含有配位键
④ (CH3)3E中E原子的杂化方式为 。
⑤该晶体中紧邻的F原子之间与紧邻的F、E两原子之间距离的比值为
(写出计算过程)
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增。B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3P轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体。根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为 (用元素符号表示)。
(2)化合物BD3的分子空间构型是 。
(3)上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED),其材料是E与F形成的化合物甲(属于第三代半导体),用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%。化合物甲的晶胞结构如右图(白球代表F,黑球代表E)。试回答:
①该晶胞中所包含的F原子(白色球)个数为 。
②与同一个E原子相连的F原子构成的空间构型为 。
③下列说法正确的是 。
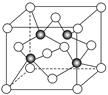
A.该晶胞结构与NaCl相同 B.半导体EB与EF互为等电子体
C.电负性:F>E D.EF晶体中含有配位键
④ (CH3)3E中E原子的杂化方式为 。
⑤该晶体中紧邻的F原子之间与紧邻的F、E两原子之间距离的比值为
(写出计算过程)
【化学――选修物质结构与性质】(15分)
有A、B、C、D、E五种元素。其相关信息如下:
请回答下列问题。
(1) 写出E元素原子基态时的电子排布式__________________;
(2) C元素的第一电离能比氧元索的第一电离能 ______ ______ (填“大”或“小”);
(3) CA3分子中C原子的杂化轨道类型是____________;
(4) A、C、E三种元素可形成配离子,其中存在的化学键类型有 ______ (填序号);
①配位键 ②金属键③极性共价键④非极性共价键⑤离子键 ⑥氢键
若具有对称的空间构型,且当
中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则
的空间构型为 ______ ______ (填序号);
a.平面正方形 b.正四面体 c.三角锥型 d. V型
(5) B与D可形成离子化合物,其晶胞结构如右图所示。其中D离子的配位数为_____,若该晶体的密度为ag • cm-3,则该晶胞的体积是______cm-3 (写出表达式即可)。
【化学――选修物质结构与性质】(15分)
有A、B、C、D、E五种元素。其相关信息如下:
请回答下列问题。
(1) 写出E元素原子基态时的电子排布式__________________;
(2) C元素的第一电离能比氧元索的第一电离能 ______ ______ (填“大”或“小”);
(3) CA3分子中C原子的杂化轨道类型是____________;
(4) A、C、E三种元素可形成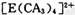 配离子,其中存在的化学键类型有 ______ (填序号);
配离子,其中存在的化学键类型有 ______ (填序号);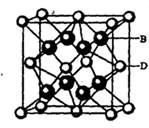
①配位键 ②金属键③极性共价键④非极性共价键⑤离子键 ⑥氢键
若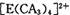 具有对称的空间构型,且当
具有对称的空间构型,且当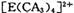 中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则
中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则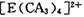 的空间构型为 ____________ (填序号);
的空间构型为 ____________ (填序号);
a.平面正方形b.正四面体c.三角锥型 d. V型
(5) B与D可形成离子化合物,其晶胞结构如右图所示。其中D离子的配位数为_____,若该晶体的密度为ag ? cm-3,则该晶胞的体积是______cm-3(写出表达式即可)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com