
题目列表(包括答案和解析)
(本题共12分)
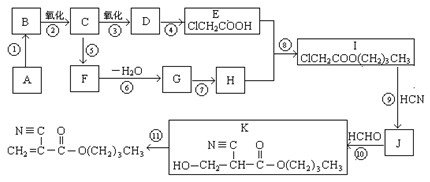
A是石油化学工业最重要的基础原料,以A为有机原料,无机试剂任选,按下列途径合成一种常见的医用胶(结构简式为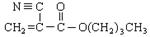 )
)
已知两个醛分子在一定条件下可以发生如下反应;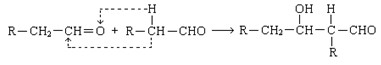
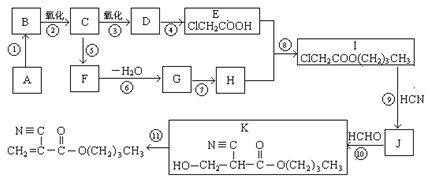
根据题意回答:
1.A的结构简式是_________________,D的官能团名称是 。
2.⑥的反应条件是 ,I→J的另一生成物是 。
3.属于取代反应的有(填反应序号)____________,⑩的反应类型是 。
4.写出⑤的化学方程式:_____________________________________________________。
5.F有多种同分异构体,其中能够在NaOH溶液中发生反应的同分异构体有 种。
6.如果以F为原料经过三步合成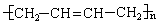 ,对应的反应类型分别为
,对应的反应类型分别为
。
(本题共12分)
A是石油化学工业最重要的基础原料,以A为有机原料,无机试剂任选,按下列途径合成一种常见的医用胶(结构简式为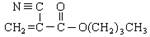 )
)
已知两个醛分子在一定条件下可以发生如下反应;
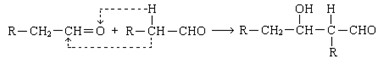
根据题意回答:
1.A的结构简式是_________________,D的官能团名称是 。
2.⑥的反应条件是 ,I→J的另一生成物是 。
3.属于取代反应的有(填反应序号)____________,⑩的反应类型是 。
4.写出⑤的化学方程式:_____________________________________________________。
5.F有多种同分异构体,其中能够在NaOH溶液中发生反应的同分异构体有 种。
6.如果以F为原料经过三步合成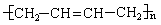 ,对应的反应类型分别为
,对应的反应类型分别为
。




 +NaOH→
+NaOH→ +H2O
+H2O +NaOH→
+NaOH→ +H2O
+H2O +3Br2→
+3Br2→ ↓+3HB
↓+3HB +3Br2→
+3Br2→ ↓+3HB
↓+3HB





| 物质 | 室温下色、态 | 密度(g/ml) | 熔点(℃) | 沸点(℃) |
| 苯甲酸 | 白色固体 | 1.2659 | 122 | 249 |
| 甲醇 | 无色液体 | 0.7915 | -97.8 | 64.65 |
| 苯甲酸甲酯 | 无色液体 | 1.0888 | -12.3 | 199.6 |
| 乙酸 | 无色液体 | \ | 16.6 | 117.9 |
| 乙醇 | 无色液体 | \ | -117.3 | 78.5 |
| 乙酸乙酯 | 无色液体 | \ | 83.6 | 77.1 |

| 浓H2SO4 |
| △ |



湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com