
题目列表(包括答案和解析)
| ||
| a |
| 32 |
| V |
| 22.4 |
| a |
| 32 |
| V |
| 22.4 |
| ||
| ||
| ||
| ||
| 71 |
| 27 |
| 71 |
| 27 |
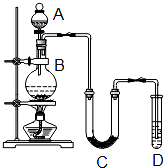 某学生设计如图所示实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应,反应后温度将升高),A中盛浓盐酸,C中盛潮湿的消石灰,据此回答下列问题:
某学生设计如图所示实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应,反应后温度将升高),A中盛浓盐酸,C中盛潮湿的消石灰,据此回答下列问题:
| ||
| ||
| ||
| A、MnO2、FeCl3、Cl2、CuCl2 |
| B、Cl2、FeCl3、MnO2、CuCl2 |
| C、MnO2、Cl2、FeCl3、CuCl2 |
| D、CuCl2、FeCl3、Cl2、MnO2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com