
题目列表(包括答案和解析)
Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示装置模拟工业制取并收集ClO2。

(1)A必须添加温度控制装置,除酒精灯、温度计外,还需要的玻璃仪器有 ???????? 。
(2)反应后在装置C中可得NaClO2溶液。已知在温度低于38℃时NaClO2饱和溶液中析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据上右图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤: ① 蒸发结晶;② ??????????? ;③ 洗涤;④ 干燥。
(3)ClO2很不稳定,需随用随制,用水吸收得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:① 准确量取ClO2溶液V1mL加入到锥形瓶中,加适量蒸馏水稀释,调节试样的pH≤2.0。② 加入足量的KI晶体,静置片刻。此时发生反应的离子方程式为:????????????? ;③ 加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定,至终点时消耗Na2S2O3溶液V2 mL。则原ClO2溶液的浓度为????????? mol/L(用含字母的代数式表示)。(已知2 Na2S2O3+I2= Na2S4O6+2NaI)
Ⅱ.将由Na+、Ba2+、Cu2+、SO42-、Cl- 组合形成的三种强电解质溶液,分别装入下图装置
中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极。

接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液pH与电解时间t的关系如右上图(忽略因气体溶解带来的影响)。据此回答下列问题:
(1)写出乙烧杯中发生反应的化学方程式?????????????????????????????????????? ;
(2)电极f上发生的电极反应为????????????????????????????? ;
(3)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是??????????????????????????????????? 。
 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH | 浓硫酸 | △ |

 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
在实验室里可用右图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。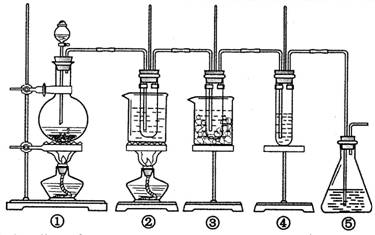
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。请填写下列空白:
(1)装置①是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其反应的化学方程式为 。
(2)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是:
A.NaBiO3 B.FeCl3 C.PbO2
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>FeCl3
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
① ;② 。
(4)反应完毕经冷却后,②的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是 (填写编号字母);从②的试管中分离出该晶体的方法是 (填写实验操作名称)。
(5)根据④的试管里紫色石蕊试液的颜色变化可否证明氯气的强氧化性 。为什么? 。
(6)一定量的氢气在氯气中燃烧,所得的混合物用100mL 3.00mol/L的NaOH溶液(密度为1.2g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。所得溶液中Cl-离子的物质的量 。
A、B、C、D、E都是周期表中前四周期的元素。已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大。B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区。C元素原子的外围电子层排布式为nsn—1npn—1。 D原子M能层为全充满状态,且最外层无成对电子,E为第四周期未成对电子数最多的元素。请回答下列问题:
(1)写出E基态原子的电子排布式 ;E在周期表中的位置是 ,其基态原子有 种能量不同的电子。
(2)某同学根据上述信息,推断B的核外电子排布如右图所示,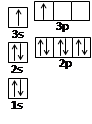
该同学所画的电子排布图违背了 。
(3)已知A和C形成的化合物X中每个原子的最外层均为8电子稳定结构,则X的化学式为 ,X是一种超硬物质,耐磨损、抗腐蚀能力强,推测X的晶体类型为 。
(4)B的单质与A的最高价含氧酸的稀溶液反应,能将A还原至最低价态,写出该反应的化学方程式 。
(5) 已知D晶体的粒子堆积方式为面心立方最密堆积,若该晶体中一个晶胞的边长为a cm,则D晶体的密度为 g/cm3(写出含a的表达式,用NA表示阿伏加德罗常数的值)。若D的原子半径为r ,则在D晶胞中用r表示出这种堆积模型的空间利用率为 。(列式表示,不需化简)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com