D
(1)全部是金属元素的区域为 B
。(1分)
(2) H (1分,填元素符号)。
(3)①见表中“Mg”和“Al”(各1分,写成名称或位置写错均不给分)。
②金属性较强的是 镁 (1分,填名称),实验是 b、c (全对3分,自选1个给1分,有错不给分)。
26.(6分,每小题2分,其中第(3)小题全对2分,自选1个给1分,有错不给分)
(1) 2 Fe(OH)3+ 5-n ClO-+ 2n
OH-= 2 FeO4n-
+ 5-n Cl-+ n+3
H2O
(2) +6 。
(3) ②③ (填序号)
27.(9分,每空1分)
(1) 酸 性, NH4++H2O NH3?H2O+H+ (写成“=”不给分)。
NH3?H2O+H+ (写成“=”不给分)。
(2)pH最小的是 ③ ;c(NH4+)最小的是 ⑤ ?填序号?。
(3)c(NH4+)的大小关系是② < ③?写成“小于”不给分)。
(4)在溶液④中, Cl-(或“氯”)离子的浓度为0.1mol/L;NH3?H2O和NH4+(或“铵根”) 离子的物质的量浓度之和为0.2 mol/L。
(5)水解程度CH3COO- = NH4+,浓度的大小关系是:c(CH3COO-) = c(NH4+)。
28. (8分)
(1)最初阶段电解反应的离子方程式为 Cu+2Br- Cu+Br2 (2分) 。
Cu+Br2 (2分) 。
(2) 2Br??2e?=Br2; 2Cl??2e?=Cl2; 4OH??4e?=2H2O+O2↑(依次每个1分)
(2H2O?4e?=4H++O2↑也给分,但三个反应式的顺序不能交换) 。
(3) 蓝色逐渐消失,最后溶液变成橙色(或橙红色) (2分) 。
(4)最终溶液显 酸 性。(1分)
29.(14分)
(1)A的化学式是H2SO3(2分);离子方程式:H2SO3+Cl2+H2O=4H++SO32-+2Cl-(3分)。
(2)Y的化学式是 SO3 (2分)。
(3)B在水中的电离方程式为 H3PO4 H++H2PO4-、 H2PO4-
H++H2PO4-、 H2PO4- H++HPO42-
H++HPO42-
HPO42- H++PO43- (各1分) 。
H++PO43- (各1分) 。
(4)单质C是 P (1分) ,其形成的晶体属于 分子晶体(1分) (填晶体类型),其与Y反应的化学方程式为 5SO3+2P=5SO2+P2O5 (2分) 。
三.计算题(本大题只有1题,共7分)
30.(7分)电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。有关反应为:2FeCl3+Cu=2FeCl2+CuCl2。
现将一块敷有铜箔的绝缘板浸入8.00×102
mL某FeCl3溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入铁粉m g,充分反应后剩余固体n g;将固体滤出并从滤液C(忽略反应前后溶液体积变化)中取出20.00mL,向其中滴入3.00mol • L-1AgNO3溶液60.00 mL时,溶液中的Cl-恰好完全沉淀。请计算:
(1)溶液A中FeCl3的物质的量浓度为 3.00mol • L-1 (1分)
;
(2)假若铁粉不再溶解,向溶液B中加入的铁粉质量至少应当大于 67.2g
(1分) ;
(3)讨论当剩余固体的组成不同时m与n可能的取值范围,并填入下表
剩余固体的组成
m的取值范围
n的取值范围
只有铜
0<m≤67.2(1分)
只写m≤67.2就给分
0<n≤76.8(1分)
只写n≤76.8就给分
有铁且有铜
m>67.2(1分)
m-67.2<n≤m+9.6(1分)
(4)当m=100.0,n=96.8时,溶液B中FeCl2的物质的量浓度为 2.5 mol • L-1。(1分)







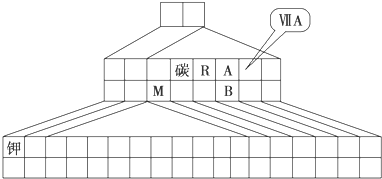
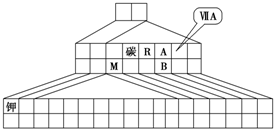 如图是元素周期表的另一种画法--三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置.
如图是元素周期表的另一种画法--三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置.