
题目列表(包括答案和解析)
水与人类的生活和生产密切相关。请回答以下相关问题:
 (一)(7分)水——常用的化
(一)(7分)水——常用的化 学试剂
学试剂
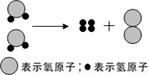
(1)作反应物:电解水时, 需在水中加入少量氢氧化钠或硫酸,目的是 ,右图是实验室电解水的微观示意图,其中最小的微粒是 ,通过该实验可以得出的结论是 ;
需在水中加入少量氢氧化钠或硫酸,目的是 ,右图是实验室电解水的微观示意图,其中最小的微粒是 ,通过该实验可以得出的结论是 ;
(2)配制溶液:小丽配制50.0 g 15.0%的氯化钾溶液的操作步骤为:
①计算:需要氯化钾固体的质量为  g;
g;
②称量:用托盘天平称取所需固体。若所用砝码生锈了,则会导致氯化钠溶液的溶质质量分数 (填“<”或“>”)15.0%;
③溶解:该操作中用 (填仪器名称)搅拌至完全溶解;
④装瓶:将配制的溶液倒入 (填“广口瓶”或“细口瓶”),并贴上标签。
(二)(3分)海水——人类的资源宝库
(1)获取淡水:将海水转化为淡水,最常用的操作方法是 ;
(2)获取NaCl:将海水进行 可得到粗盐;为除去粗盐中含有的Na2SO4、CaCl2等杂质,可依次进行下列操作:①溶解;②加过量的BaCl2溶液; ③加过量的Na2CO3溶液;④过滤;⑤加适量的X溶液;⑥蒸发结晶。其中适量X溶液是 (填名称);
(三)(9分)清洁卫生的水——人类需要
(1)下列保护运河水的建议中,合理的是 (填序号);
①生活污水处理后排放; ②将工厂废液排入运河; ③使用无磷洗衣粉;
④减少燃放烟花爆竹; ⑤及时清理运河中疯长的藻类
 (2)以下是污水处理成自来水的工艺流程示意图:
(2)以下是污水处理成自来水的工艺流程示意图:
①污水中含Ca2+、Mg2+、HCO3—等,加入生石灰后生成Ca(OH)2,进而发生若干复分解反应,初级沉降池中生成的主要沉淀是 和 ;(MgCO3微溶于水)
②通入CO2除了能调节自来水的pH,还能 ;
③生物反应池是利用微生物直接分解水中的有机物,以除去水中过多的氮 、磷等有害成分。这样做的优点是 ;
、磷等有害成分。这样做的优点是 ;
④为除去水中悬浮的固体小颗粒,常用的混凝剂是 (填名称);
⑤气体A是 (填化学式),其作用是杀菌消毒,使自来水符合卫生标准,A和H2O反应生成HClO和HCl,写出该反应的化学方程式 ;
⑥饮用含有大量的细菌和杂质的水后,很容易患肠道传染病。请你设计合理方案,将被污染的水处理成能饮用的水: 。
水与人类的生活和生产密切相关。请回答以下相关问题:
(一)(7分)水——常用的化学试剂
 (1)作反应物:电解水时,需在水中加入少量氢氧化钠或硫酸,目的是 ▲ ,右图是实验室电解水的微观示意图,其中最小
(1)作反应物:电解水时,需在水中加入少量氢氧化钠或硫酸,目的是 ▲ ,右图是实验室电解水的微观示意图,其中最小 的微粒是 ▲ ,通过该实验可以得出的结论是 ▲ ;
的微粒是 ▲ ,通过该实验可以得出的结论是 ▲ ;
(2)配制溶液:小丽配制50.0 g 15.0%的氯化钾溶液的操作步骤为:
①计算:需要氯化钾固体的质量为 ▲ g;
②称量:用托盘天平称取所需固体。若所用砝码生锈了,则会导致氯化钠溶液的溶质质量分数 ▲ (填“<”或“>”)15.0%;
③溶解:该操作中用 ▲ (填仪器名称)搅拌至完全溶解;
④装瓶:将配制的溶液倒入 ▲ (填“广口瓶”或“细口瓶”),并贴上标签。
(二)(3分)海水——人类的资源宝库
(1)获取淡水:将海水转化为淡水,最常用的操作方法是 ▲ ;
(2)获取NaCl:将海水进行 ▲ 可得到粗盐;为除 去粗盐中含有的Na2SO4、CaCl2等杂质,可依次进行下列操作:①溶解;②加过量的BaCl2溶液; ③加过量的Na2CO3溶液;④过滤;⑤加适量的X溶液;⑥蒸发结晶。其中适量X溶液是 ▲ (填名称);
去粗盐中含有的Na2SO4、CaCl2等杂质,可依次进行下列操作:①溶解;②加过量的BaCl2溶液; ③加过量的Na2CO3溶液;④过滤;⑤加适量的X溶液;⑥蒸发结晶。其中适量X溶液是 ▲ (填名称);
(三)(9分)清洁卫生的水——人类需要
(1)下列保护运河水的建议中,合理的是 ▲ (填序号);
①生活污水处理后排放; ②将工厂废液排入运河; ③使用无磷洗衣粉;
④减少燃放烟花爆竹; ⑤及时清理运河中疯长的藻类
(2)以下是污水处理成自来水的工艺流程示意图:
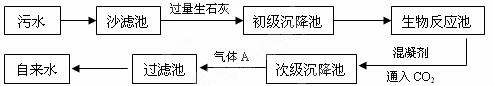
①污水中含Ca2+、Mg2+、HCO3—等,加入生石灰后生成Ca(OH)2,进而发生若干复分解反应,初级沉降池中生成的主要沉淀是 ▲ 和 ▲ ;(MgCO3微溶于水)
②通入CO2除了能调节自来水的pH,还能 ▲ ;
③生物反应池是利用微生物直接分解水中的有机物,以除去水中过多的氮、磷等有害成分。这样做的优点是 ▲ ;
④为除去水中悬浮的固体小颗粒,常用的混凝剂是 ▲ (填名称);
⑤气体A是 ▲ (填化学式) ,其作用是杀菌消毒,使自来水符合卫生标准,A和H2O反应生成HClO和HCl,写出该反应的化学方程式 ▲ ;
,其作用是杀菌消毒,使自来水符合卫生标准,A和H2O反应生成HClO和HCl,写出该反应的化学方程式 ▲ ;
⑥饮用含有大量的细菌和杂质的水后,很容易患肠道传染病。请 你设计合理方案,将被污染的水处理成能饮用的水: ▲ 。
你设计合理方案,将被污染的水处理成能饮用的水: ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com