
题目列表(包括答案和解析)
| 实验编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和 c.实验①和④探究 |
| ② | 0.5 | 0.001 | ||
| ③ | 323 | 0.010 | ||
| ④ | 298 | 0 | 0.010 |
I:化学是一门以实验为主的科学,化学实验是学习探究物质性质的基本方法之一。(1)化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是
A.定性检验SO32-,可用HNO3酸化的BaCl2溶液
B.配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程度
C.检验某溶液中是否含Cl-,用HNO3酸化的AgNO3溶液
D.酸性高锰酸钾溶液经常用盐酸酸化
(2)下列有关说法中正确的有??????? ?
①用pH试纸测得氯水的pH为3.5
②用瓷坩埚高温熔融NaOH固体
③加入浓NaOH溶液,加热产生使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定含有NH4+
④向溶液中加入少量双氧水,再加几滴KSCN溶液后溶液变红,则原溶液中一定含有Fe2+
⑤实验时不慎被玻璃划破手指,引起轻微流血时,可用三氯化铁溶液涂抹止血
II:(1)某温度下,纯水中c(H+)=2.0×10-7mol·L-1.该温度下,0.9mol·L-1NaOH溶液与0.1mol·L-1 HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH= ???? 。
(2)向含有0.020 molCH3COOH的溶液中加入0.020mol CH3COONa固体,溶液pH增大,主要原因是 ?? ?? ;已知该混合溶液中c(Na+)<c(CH3COO-),则c(CH3COOH)?????? c(CH3COO-)(用“>”、“<”、“=”符号填空)。
(3)常温下,向100 mL 0.01mol·L-1HA溶液逐滴加入0.02mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。
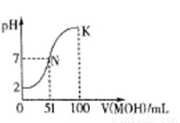
回答下列问题:
①由图中信息可知HA为??? 酸(填“强”或“弱”)。
②K点对应的溶液中,c(M+)+c(MOH)=???? mol·L-1。
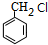
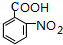
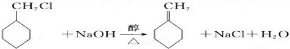
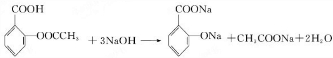
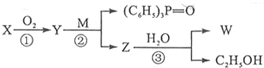
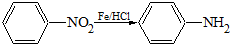 (苯胺,易被氧化).甲苯是一种重要的有机化工原料,可用来合成多种重要的有机物.以甲苯为初始原料合成阿司匹林等有机物的转化关系图(部分产物、合成路线、反应条件略去)如下.
(苯胺,易被氧化).甲苯是一种重要的有机化工原料,可用来合成多种重要的有机物.以甲苯为初始原料合成阿司匹林等有机物的转化关系图(部分产物、合成路线、反应条件略去)如下.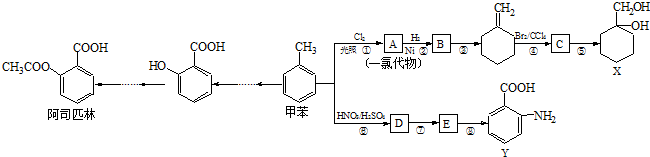




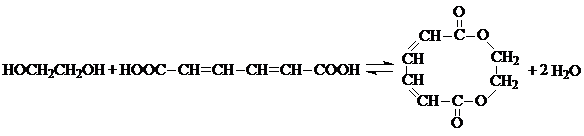
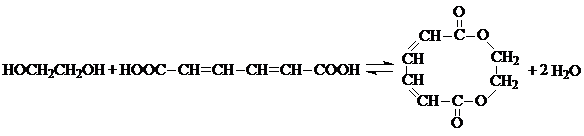
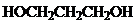
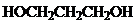
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com