
题目列表(包括答案和解析)
(每空2分,共16分)短周期元素X、Y、Z、W,原子序数依次增大。常温常压下,只有W的单质为气体。它们的最高氧化物对应的水化物依次为甲、乙、丙、丁。甲、乙、丙是中学化学中的常见物质,其中只有乙难溶于水,且能和甲、丙反应得到澄清溶液。根据以上信息填写下列空白:
⑴画出W的原子结构示意图_________________________________________;
⑵将乙和甲、丙分别反应后得到的溶液混合,观察到的现象是___________________
___________________ ,两溶液混合时所发生反应的离子方程式为____________________________________________________;
⑶下列事实能证明Z和W非金属性强弱的是(选填序号)__________________________;
| A.单质的熔点:Z>W2 |
| B.酸性:丁>丙 |
| C.在溶液中:W2+H2Z=2HW+Z |
| D.稳定性:HW>H2Z |
(每空2分,共16分)短周期元素X、Y、Z、W,原子序数依次增大。常温常压下,只有W的单质为气体。它们的最高氧化物对应的水化物依次为甲、乙、丙、丁。甲、乙、丙是中学化学中的常见物质,其中只有乙难溶于水,且能和甲、丙反应得到澄清溶液。根据以上信息填写下列空白:
⑴画出W的原子结构示意图_________________________________________;
⑵将乙和甲、丙分别反应后得到的溶液混合,观察到的现象是___________________
___________________ ,两溶液混合时所发生反应的离子方程式为____________________________________________________;
⑶下列事实能证明Z和W非金属性强弱的是(选填序号)__________________________;
A.单质的熔点:Z>W2 B.酸性:丁>丙
C.在溶液中:W2+H2Z=2HW+Z
D.稳定性:HW>H2Z E.氢化物水溶液的酸性:HW>H2Z
F.溶解性:丁>丙
⑷用Y单质和生活中最常用的金属作电极,用导线连接插入甲的溶液中构成原电池,该原电池负极的电极反应式为_______________________________________________ ;
⑸工业上以XW为原料可以进行许多化生产,甲和W2都是其主要产品。写出工业上以XW为原料生产甲和W2的化学方程式_______________________________________________
_______________________________________________;若要生产80.0 kg甲物质,至少需要XW______________kg,同时可得W2_____________m3(标况)。
| A.单质的熔点:Z>W2 |
| B.酸性:丁>丙 |
| C.在溶液中:W2+H2Z=2HW+Z |
| D.稳定性:HW>H2Z |
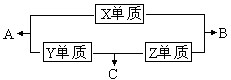 X、Y、Z、W四种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、W四种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:

| ||
| △ |
| ||
| △ |
| ||
| ||
| △ |
| △ |
 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化: NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+
一、选择题(每小题只有一个选项符合题意,每小题6 分)
1―5ACDCB 6―10DABAD 11―13BDA
二、选择题(本大题包括8 个小题,每小题6 分,共48 分。在每小题给出的四个选项中,有的小题只有一个正确选项,有的小题有多个正确选项,全部选对的得6 分,选对但不全的得3分,有选错或不答的得0 分)
14.B 15.C 16.AD 17.BD 18.B 19.D 20.D 21.D
三、非选择题
22.(a)(6 分)不是; s 与t 不呈线性关系; 减小长木板的倾角. (每空2 分)
(b)(12 分)(1)R3. R2. E. (4 分,少一个扣1 分)
(2)13.3Ω. (4 分)
(3)滑动变阻器断路; R2断路或R3短路. (4 分,少一种情况扣1 分)
23.(16 分)(1)小球通过P 物体的平均时间:
t =(0.019 + 0.020 + 0.021 + 0.021 + 0.019)/5 = 0.020s 2 分
由已知可知小球刚到达P 的顶端的速度: V1 =
h/t = 1.2/0.020 =
则楼顶距P 物体顶端的距离:  4 分
4 分
(2)由(1)可知,设小球到达物体P 顶端速度为v2,则:
 3 分
3 分
设下抛初速度为v0,则: 3 分
3 分
由以上两式可得:  2 分
2 分
24.(18 分)(1)要使滑块A 能以与B 碰前瞬间相同的速度与C 碰撞,必须使小球B 受A 撞击后在竖直平面内完成一个完整的圆周运动后从左方撞击A,使A 继续向右运动。
设A 从距水平面高为H 的地方释放,与B 碰前的速度为v0
对A,由机械能守恒得: ①2
分
①2
分
向心力 2 分
2 分
设小球B 通过最高点的速度为vB,则它通过最高点的条件是: 2 分
2 分
小球B 从最低点到最高点机械能守恒: ③2
分
③2
分
联立①②③得H
评价说明:如果于式中的“≤”、④式中的“≤”写成“=”,又没有用文字表明是极值的,该式为零分
(2)从这个高度下滑的A 与C碰撞前瞬间速度 ⑤2
分
⑤2
分
设A 与C 碰后瞬间的共同速度为v,由动量守恒: ⑥ 2 分
⑥ 2 分
|