
题目列表(包括答案和解析)
 金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.
金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.| 1 |
| 5 |
| 2 |
| 9 |
| 1 |
| 4 |
| 1 |
| 3 |
| 1 |
| 2 |
(14分)(1)向1 L AlCl3和FeCl3混合溶液中加入含a mol NaOH的溶液时,产生的沉淀量可达最大值;继续加入NaOH溶液,沉淀开始溶解,当前后加入的NaOH总量达到b mol时,沉淀不再减少,则原溶液中Fe3+的物质的量浓度为 ,AlCl3的物质的量 。
(2)已知:2Fe3++2I- = 2Fe2++ I2; 2Fe2++Br2 = 2Fe3++2Br-
①向含有1mol FeI2和1.5mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是 。
②如果向①的溶液中通入3mol Cl2,则被氧化的离子对应的氧化产物分别是 。
(3)①若m g铁屑与含有 n gHNO3的硝酸溶液恰好完全反应,若 m : n =" 1" : 2.7, 该反应的化学方程式为 __________________________________________________(假设还原产物只有一种,且只生成一种盐)
②若含 n g HNO3的稀硝酸溶液恰好使5.6g铁粉完全溶解,若有 n/4 gHNO3被还原成NO(无其它还原产物)则 n 的范围为_________________________
③某条件下锌和硝酸反应时的物质的量之比为2:5,此时硝酸的还原产物是____________
(14分)(1)向1 L AlCl3和FeCl3混合溶液中加入含a mol NaOH的溶液时,产生的沉淀量可达最大值;继续加入NaOH溶液,沉淀开始溶解,当前后加入的NaOH总量达到b mol时,沉淀不再减少,则原溶液中Fe3+的物质的量浓度为 ,AlCl3的物质的量 。
(2)已知:2Fe3++2I- = 2Fe2++ I2; 2Fe2++Br2 = 2Fe3++2Br-
①向含有1mol FeI2和1.5mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是 。
②如果向①的溶液中通入3mol Cl2,则被氧化的离子对应的氧化产物分别是 。
(3)①若m g铁屑与含有 n gHNO3的硝酸溶液恰好完全反应,若 m : n =" 1" : 2.7, 该反应的化学方程式为 __________________________________________________(假设还原产物只有一种,且只生成一种盐)
②若含 n g HNO3的稀硝酸溶液恰好使5.6g铁粉完全溶解,若有 n/4 gHNO3被还原成NO(无其它还原产物)则 n 的范围为_________________________
③某条件下锌和硝酸反应时的物质的量之比为2:5,此时硝酸的还原产物是____________
(12 分 )金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大。
(1)钢铁的表面发蓝、发黑处理是常用的防腐方法。下列反应是主要反应之一。
请配平方程式:口Na2FeO2+ 口 NaNO2+ 口 = 口 NaFeO2+ 口 NH3↑+ 口 NaOH
 (2)钢铁的“钝化”处理也能达到防腐目的,经
(2)钢铁的“钝化”处理也能达到防腐目的,经
冷、浓 HNO3处理后,其表面有一层致密氧化物保
护膜,但是加热或在稀HNO3中 就不能 “钝化”。
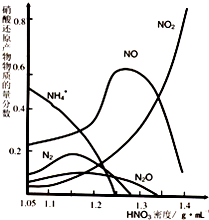
不同浓度的 HNO3与铁反应的还原产物很复杂,
其分布曲线如图。
① 图示可知,密度为 1.05g·mL-1 的硝酸与铁
反应时,其最多的还原产物是 ;密度大于1.35 g·mL-1的硝酸与铁反应时,其还原产物主要是 NO2;分析HNO3 与铁反应的规律是:
。
② mg 铁与含 n g HNO3的硝酸溶液恰好完全反应,若硝酸的还原产物只有NO, 则 m 的取值可能是 (填字母编号 )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]() E.
E.![]()
③工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是: 。
(3)金属 (M) 的腐蚀是因为发生反应: M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是 (填字母编号)
A.在铁中掺入铭、镇等金属,改变其内部结构,制成不锈钢
B.在铁制品表面镀辞
C.提高铁中含碳量,制成生铁
D.将水库铁闸门与直流电源的负极相连
(1)m g铁屑与含有 n gHNO3的硝酸溶液恰好完全反应,若 m : n = 1 : 2.7,该反应的化学方程式为__________________________________________________________(假设还原产物只有一种,且只生成一种盐)(3分)
(2)含 n g HNO3的稀硝酸溶液恰好使5.6g铁粉完全溶解,若有 n/4 gHNO3被还原成NO(无其它还原产物)则 n 的范围为_________________________(3分)
(3)某条件下锌和硝酸反应时的物质的量之比为2:5,此时硝酸的还原产物是____________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com