
题目列表(包括答案和解析)
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||
据新华社报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的汽化和液化可以提高燃料的利用率。
已知25℃,101kPa时:C(s) +1/2O2(g)=CO(g) ΔH= -126.4 kJ·mol-1
2H2(g) +O2(g)=2H2O(l) ΔH= -571.6 kJ·mol-1 H2O(g)= H2O(l) ΔH= -44 kJ·mol-1
则在25℃,101kPa时:C(s) + H2O(g)= CO(g) + H2(g) ΔH=____________________。
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) ![]() Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值__________(填“增大”、“减小”或“不变”);
②1100℃时测得高炉中,c(CO2)=0.025mol·L-1,c(CO)=0.1 mol·L-1,则在这种情况下,该平衡_______移动(填“向左”、“向右”或“不”),判断依据是
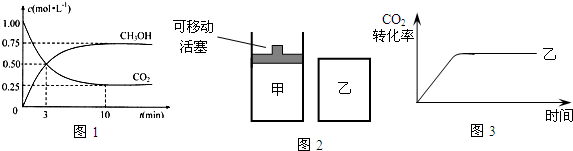
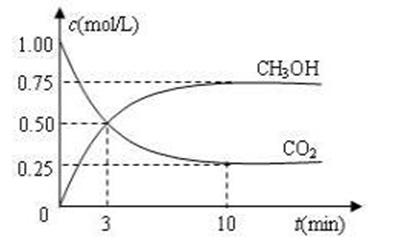
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
|
 | ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
|
| |||||||||||||
| ||||||||||||||
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________;
②下列措施能使![]() 增大的是________(填符号)。
增大的是________(填符号)。
A.升高温度 B.再充入H2 C.再充入CO2
D.将H2O(g)从体系中分离 E.充入He(g),使体系压强增大
一、选择题(48分)
1.B 2.B 3.D 4.C 5.A 6.A D 7.B C 8.A B
理科综合.files/image211.jpg) 二、实验题(18分)
二、实验题(18分)
9.(1)(6分)
10.红光(4分)
11.(1)R理科综合.files/image068.gif) (或C)(2分) (2)如图(2分)
(或C)(2分) (2)如图(2分)
(3)896.4理科综合.files/image214.gif) (2分) 偏大 (2分)
(2分) 偏大 (2分)
三、计算题(54分)
12.(16分)解:小车固定在地面时,设物体与小车间摩擦力为f,由动能定理
理科综合.files/image216.gif) (1)
(1)
把小车放在光滑水平地面上时,小物体与小车间摩擦力仍为f.设小物体相对小车滑行距离为L时,跟小车相对静止(未能滑离小车)共同速度为V,由动量守恒定律
理科综合.files/image218.gif) (2)
(2)
设这过程小车向前滑行距离为S。由动能定理
对小车有理科综合.files/image220.gif) (3)
(3)
对小物体有理科综合.files/image222.gif)
由(2)(3)(4)解出理科综合.files/image224.gif) (5)
(5)
理科综合.files/image226.gif) 且
且理科综合.files/image228.gif) (6)
(6)
比较(5)(6)解出理科综合.files/image230.gif) ,只要
,只要理科综合.files/image232.gif) 小物体就能滑离小车
小物体就能滑离小车
13.(18分) 解:(1)理科综合.files/image234.gif)
(2)刚释放理科综合.files/image236.gif) 棒时,
棒时,理科综合.files/image238.gif)
理科综合.files/image236.gif) 棒受到安培力为:
棒受到安培力为:理科综合.files/image241.gif)
理科综合.files/image236.gif) 棒受到的种力为:
棒受到的种力为:理科综合.files/image244.gif)
理科综合.files/image246.gif) 棒沿导轨向下加速滑动,既abcd闭合回路的
棒沿导轨向下加速滑动,既abcd闭合回路的理科综合.files/image248.gif) 增大;
增大;
电流也将增大,所以最小电流为:理科综合.files/image250.gif) ;
;
当理科综合.files/image236.gif) 棒的速度达到最大时,回路的电流最大,此时
棒的速度达到最大时,回路的电流最大,此时理科综合.files/image236.gif) 棒的加速度为零。
棒的加速度为零。
由理科综合.files/image254.gif) 得
得理科综合.files/image256.gif)
(3)由:理科综合.files/image258.gif) 得:
得:理科综合.files/image260.gif)
14.解:(20分)(1)带电粒子从原点射出进入匀强磁场,在垂直于磁场的理科综合.files/image262.gif) 平面内做匀速圆周运动由左手定则判断磁场的方向垂直于
平面内做匀速圆周运动由左手定则判断磁场的方向垂直于理科综合.files/image262.gif) 平面指向纸外。从粒子进入电场受力作用而速度偏高分析判断:电场强度方向是平行x轴,沿
平面指向纸外。从粒子进入电场受力作用而速度偏高分析判断:电场强度方向是平行x轴,沿理科综合.files/image265.gif) 轴负方向。
轴负方向。
理科综合.files/image267.jpg)
理科综合.files/image269.gif) 距离应是带电粒子在匀强磁场中作圆周运动的轨迹直径,从
距离应是带电粒子在匀强磁场中作圆周运动的轨迹直径,从理科综合.files/image094.gif) 到
到理科综合.files/image034.gif) 经理半个周期,即:
经理半个周期,即:
理科综合.files/image273.gif) ①
①
理科综合.files/image275.gif) ②
②
解出理科综合.files/image277.gif) ③
③
理科综合.files/image279.gif)
(2)带电粒子以理科综合.files/image281.gif) (大小等于
(大小等于理科综合.files/image077.gif) 的大小)垂直射入匀强电场,受电场力作用而做曲线运动,(相当于平抛运动轨迹)
的大小)垂直射入匀强电场,受电场力作用而做曲线运动,(相当于平抛运动轨迹)
设匀强电场的场强大小为E,粒子射出电场的速度为理科综合.files/image284.gif) ,
,
理科综合.files/image286.gif) ⑤
⑤
理科综合.files/image288.gif) ⑥
⑥
理科综合.files/image290.gif) ⑦
⑦
理科综合.files/image292.gif) ⑧
⑧
射出电场时理科综合.files/image284.gif) 与
与理科综合.files/image295.gif) 轴夹角120°,即与
轴夹角120°,即与理科综合.files/image297.gif) 夹角60°
夹角60°
理科综合.files/image299.gif) ⑨
⑨
由⑤、⑥、⑦、⑧、⑨解出 理科综合.files/image301.gif)
理科综合.files/image303.gif) ①―⑨式子每个2分 结果2分
①―⑨式子每个2分 结果2分
(化学部分)参考答案
1.A 2.B 3.D 4.B 5.C 6.C
7.(14分)
(1)理科综合.files/image305.jpg)
理科综合.files/image307.gif)
(2)第三周期第ⅥA族
理科综合.files/image309.gif)
理科综合.files/image311.gif)
(3)理科综合.files/image313.gif)
8.(18分)
(1)理科综合.files/image315.gif)
(2)羟基 取代反应 消去反应
(3)1:1:3
(4)理科综合.files/image317.jpg)
(5)理科综合.files/image318.jpg)
(生物部分)参考答案
一、单项选择题(每题6分,共36分)
1.A 2.C 3.D 4.C 5.B 6.C
二、非选择题(除标注外,每空2分,共44分)
7.(1)细菌 营养物质消耗尽了
(2) 图画准确 (2分)。 有a、b标示(1分) 捕食
理科综合.files/image320.jpg)
(3)细菌 小球藻 细菌可以为小球藻提供矿质营养与二氧化碳、小球海可以为细菌提供有机营养与氧气
8(一) (1)光反应 色素的数量 二氧化碳含量、温度等
(2) 酶的活性 (3)三碳化合物
(4)
适当降低室内温度 因为在该光照强度以下,
低温时(
8(二)(1) ①切成大小相等的若干小块
②分别加入10ml (等量)过氧化氢溶液
③再分别加入2,4,6个土豆小块
④定时观察记录针筒内体积的变化。
(2)温度 土豆的新鲜程度 注射器的密封性 注射器针筒与活塞之间的摩擦力等(任答两项,其他答案合理也可)
(3)延长、缩短
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com