
题目列表(包括答案和解析)
| 硫酸 体积:500mL 化学式:H2SO4 密度:1.84g/cm3 质量分数:98% |
| 硫酸 体积:500mL 化学式:H2SO4 密度:1.84g/cm3 质量分数:98%(1)该试剂瓶中硫酸溶液的质量是920g,李博同学用该硫酸配制20%的稀硫酸.他在配制该溶液时所用浓硫酸与水的质量比为 10:39 10:39 .(2)现有某固体,只知道含氢氧化铜、硫酸钠、碳酸钠中的一种或几种.为了测定固体的成分,取l0g该固体于烧杯中,加26.7g水,搅拌,得到无色溶液:再向烧杯中加入李博同学配制好的稀硫酸24.5g,恰好完全反应. ①固体样品成分的化学式为 Na2CO3和Na2SO4 Na2CO3和Na2SO4 .②发生反应的化学方程式为 Na2CO3+H2SO4═Na2SO4+H2O+CO2↑ Na2CO3+H2SO4═Na2SO4+H2O+CO2↑ .③利用已知条件列出求解与硫酸反应的物质质量(x)的比例式
④反应后烧杯中溶液的溶质质量分数为 20% 20% .
(14分)实验室获取氮气有很多种途径,常见的有3种方法。 (14分)实验室获取氮气有很多种途径,常见的有3种方法。 方法一:将氨气(NH3)通过赤热的装有氧化铜的玻璃管,生成铜、氮气和水蒸气,除去水蒸气后测得氮气的密度为1.2508g/L。 方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末,测得该气体的密度为1.2572g/L。 进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置)。 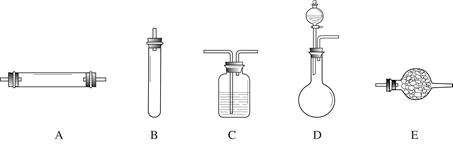 为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置 (选填装置编号)中加入 (填名称)以除去其它杂质气体。 方法三:将亚硝酸钠(NaNO2)和氯化铵的饱和溶液加热,氮元素全部转化为氮气。下图是实验室用这种方法制N2,并测定生成N2体积的装置(部分装置略去),请回答相关问题。 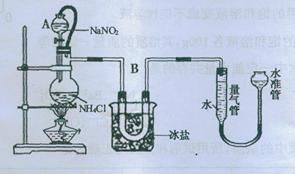 【查阅资料】 (1)NaNO2+NH4Cl  NaCl+N2↑+2H2O NaCl+N2↑+2H2O(此反应会放出大量的热); (2)B部分中冰盐是冷凝作用 【实验探究】 ① ; ②20℃时,取含溶质0.21g饱和NH4Cl溶液放入烧瓶,连接装置; ③调节水准管,使其与量气管中液面相平,记录量气管中水面读数为12.0mL; ④打开分液漏斗活塞,逐滴滴入饱和NaNO2溶液,加热至反应发生,移走酒精灯; ⑤烧瓶中不再产生气泡时,关闭活塞; ⑥待冷却至室温,调节两边液面高度相平,记录量气管中水面读数为100.0mL; ⑦处理剩余药品,整理实验台。 【实验分析及数据处理】 (1)加入药品前必须进行的实验①是 ; (2)步骤④中,移走酒精灯的目的是 ; (3)计算生成氮气的质量和密度。 (4分,计算过程中以及最终数据均保留2位小数) 【解释与结论】 1892年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件下比其他方法得到的纯氮气密度总是偏大5‰左右。若实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因是 (已知:相同条件下,气体的相对分子质量越大,密度就越大) 【反思与评价】 (1)装置中A部分的分液漏斗与蒸馏瓶之间连接的导管所起的作用是 C 防止NaNO2饱和溶液蒸发 B.保证实验装置不漏气 C.使NaNO2饱和溶液顺利滴下 D.防止溶液冲入U形管 (2)科学家瑞利仅仅是从小数点第三位数的差别,发现了新物质。这启示我们在今后的学习 和生活中要学习科学家的 . A.严谨求实的科学态度和敢于怀疑的批判精神 B.科学研究中遇到疑惑就趁早放弃,不要浪费时间 C.不能因为微小的差异而放过一次成功的机会 D.要相信权威,权威一定是正确的 Ⅰ.下表是NaCl和KCl的溶解度数据,请回答下列问题.
(2)将80℃时,同质量的NaCl和KCl的饱和溶液,分别冷却到0℃,析出晶体最多的是_______(填“NaCl”或“KCl”)溶液. (3)20℃时,向两只分别盛有35g NaCl和KCl固体的烧杯中,各加入100g水,充分溶解后,能形成饱和溶液的物质是______,其溶液的溶质质量分数是______(精确到0.1%). (4)温度不变的情况下,若要将接近饱和的KCl溶液变成饱和溶液,可采用的方法是______ _______.(写一种) Ⅱ.阅读下列三段材料,回答问题: 材料一:l869年,俄国化学家门捷列夫对已发现的元素进行研究,制作了元素周期表(右表是其片断),并在他的元素周期表中留下了许多空位代表尚未发现的新元素,其中就预言了“类铝”这种新元素. 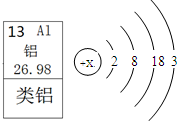 材料二:l875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,密度4.7g?cm-3,能与水剧烈反应生成氢气和氢氧化镓.不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9-6.0g?cm-3之间. 材料三:l876年,布瓦博德朗将金属镓提纯后测得镓的密度为5.94g?cm-3,从而验证了元素周期表的正确性.随后科学家根据元素周期表的空位,按图索骥,发现了许多新元素.目前金属镓广泛用于制造半导体材料.镓的原子结构示意图如右图所示. (1)镓元素的质子数为______,其氯化物的化学式为______. (2)请根据上述材料,小结金属镓的有关知识: ①物理性质:镓是银白色金属,密度为5.94g?cm-3 ②化学性质(请用化学方程式表示):______; ③用途:______. 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 | |||||||||||||||||||||||||||||||