
5. (1) 2FeTiO3+6C+7Cl2 2FeCl3+2TiCl4+6CO
2FeCl3+2TiCl4+6CO
(2) ①向逆反应方向进行 ②1.0
(3) ①CH3OH-6e-+8OH- C
C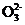 +6H2O
+6H2O
②2.8 L
4. (1) 酸性 4
(2) ①C(s)+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
ΔH=+131.3 kJ·mol-1 ②ab
(3) ①4×10-6 该反应是吸热反应,温度升高,反应速率加快,平衡向正反应方向移动,因此单位时间内NO排放量越大 ②2CO(g) 2C(s)+O2(g)是一个熵值减小的反应,同时又是ΔH>0,所以任何温度条件下均不能自发反应
2C(s)+O2(g)是一个熵值减小的反应,同时又是ΔH>0,所以任何温度条件下均不能自发反应
3. (1) 3NO2+H2O 2HNO3+NO
2HNO3+NO
(2) ①N2(g)+O2(g) 2NO(g)
2NO(g)
ΔH=+183 kJ·mol-1 ②增大
(3) 2NO+2CO N2+2CO2
N2+2CO2
(4) ①还原 ②NO+O2--2e- NO2
NO2
2. (1) CH4+H2O CO+3H2
CO+3H2
(2) ①< ②增大 ③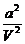
(3) CH3OCH3-12e-+3H2O 2CO2+12H+
2CO2+12H+
(4) -246.4kJ·mol-1
1. (1) bc 2.67(或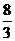 )
)
(2) (NH4)3PO4[或(NH4)2HPO4或NH4H2PO4]
8. 已知在常温下Cu2+和Fe3+在溶液中随pH变化时水解的曲线如图1所示。某同学欲提纯含有少量FeCl3和稀盐酸的CuCl2溶液。
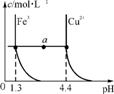
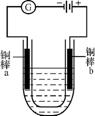
图1 图2
(1) 对图中a点的说法正确的是 (填序号)。
①加适量NH4Cl固体可使溶液由a点沿水平方向变到Cu2+曲线上
②溶液中a点和水平线在Fe3+和Cu2+曲线上任意截点的c(H+)与c(OH-)乘积相等
③Fe(OH)3、Cu(OH)2在a点代表的溶液中均达到饱和
(2) 向含有少量FeCl3和稀盐酸的CuCl2溶液中,加入稍过量的黑色粉末A搅拌、过滤,得到较纯净的CuCl2溶液。A的化学式为 ,加入A的作用是 。
(3) 用铜棒作电极,用直流电源电解CuCl2溶液,装置如图2所示。观察到的现象如下:①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;②5 min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;③10 min后,最靠近a极的白色沉淀开始变成红色;④12min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;⑤a极一直有大量气泡产生;⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显红色。[已知:Ksp(CuOH)<Ksp(CuCl)]
①a极发生的电极反应为 。
②电解5min后,b极发生的电极反应为 。
③12min后,b极附近出现橙黄色沉淀的成分是 ,
原因是 。
④最后沉淀的成分是 ,请设计一实验验证此成分: 。
反应原理综合训练
7. (1) 钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶性弱酸盐。已知:
SrSO4(s) Sr2+(aq)+S
Sr2+(aq)+S (aq)(Ksp=2.5×10-7)
(aq)(Ksp=2.5×10-7)
SrCO3(s) Sr2+(aq)+C
Sr2+(aq)+C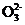 (aq)(Ksp=2.5×10-9)
(aq)(Ksp=2.5×10-9)
将SrSO4转化成SrCO3的离子方程式为 ,该反应的平衡常数表达式为 ;该反应能发生的原因是 (用沉淀溶解再平衡的有关理论解释)。 ?
(2) 对于上述反应,实验证明增大C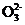 的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将 ;②增大C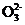 的浓度,平衡常数K将 。
的浓度,平衡常数K将 。
(3) 已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3。实验所用试剂为 ;写出实验现象及其相应结论: 。
(4) BaCl2溶液和Ba(NO3)2溶液是实验中检验S 的常用试剂。某化学研究性学习小组检验某溶液中存在S
的常用试剂。某化学研究性学习小组检验某溶液中存在S 时,首先加入Ba(NO3)2溶液,产生白色沉淀,然后加入过量稀硝酸,白色沉淀不溶解,由此得出结论:溶液中一定含有S
时,首先加入Ba(NO3)2溶液,产生白色沉淀,然后加入过量稀硝酸,白色沉淀不溶解,由此得出结论:溶液中一定含有S 。
。
你认为该推理是否严密?试说明理由: 。
6. (改编题)氮氧化物是造成雾霾天气的主要原因之一。消除氮氧化物有多种方法。
(1) 硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g) 2H2O(g) ΔH=-483.6kJ·mol-1
2H2O(g) ΔH=-483.6kJ·mol-1
N2(g)+2O2(g) 2NO2(g) ΔH=+67.7kJ·mol-1
2NO2(g) ΔH=+67.7kJ·mol-1
则H2还原NO2生成水蒸气反应的热化学方程式是 。
(2) NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。发生的化学反应是2NH3(g)+NO(g)+NO2(g)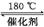 2N2(g)+3H2O(g) ΔH<0。为提高氮氧化物的转化率可采取的措施是 。
2N2(g)+3H2O(g) ΔH<0。为提高氮氧化物的转化率可采取的措施是 。
(3) 利用ClO2氧化氮氧化物反应过程如下:
NO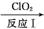 NO2
NO2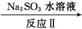 N2
N2
反应Ⅰ的化学方程式是2NO+ClO2+H2O NO2+HNO3+HCl,反应Ⅱ的化学方程式是 。若有11.2LN2生成(标准状况),共消耗ClO2 g。
NO2+HNO3+HCl,反应Ⅱ的化学方程式是 。若有11.2LN2生成(标准状况),共消耗ClO2 g。
(4) 工业废气中含有的NO2还可用电解法消除。用NO2为原料可制新型绿色硝化剂N2O5。制备方法之一是先将NO2转化为N2O4,然后采用电解法制备N2O5,装置如下图所示。
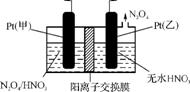
Pt(甲)为 极,电解池中生成N2O5的电极反应式是 。
5. (改编题)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如下图所示),大大地提高了资源利用率,减少了环境污染。
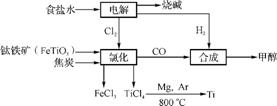
请回答下列问题:
(1) 写出钛铁矿经氯化得到四氯化钛的化学方程式: 。
(2) 由CO和H2合成甲醇的方程式是CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将 (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
②若不考虑生产过程中物质的任何损失,该产业链中每合成19.2 t甲醇,至少需额外补充H2 t。
(3) 用甲醇 空气碱性(KOH)燃料电池作电源电解精炼粗铜(如右图),在接通电路一段时间后纯Cu质量增加3.2
g。
空气碱性(KOH)燃料电池作电源电解精炼粗铜(如右图),在接通电路一段时间后纯Cu质量增加3.2
g。
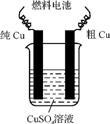
①请写出燃料电池中的负极反应式: 。
②燃料电池正极消耗空气的体积是 (标准状况,空气中O2的体积分数以20%计算)。
4. (2013·天津理综)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1) 将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
|
离 子 |
K+ |
Na+ |
N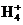 |
S |
N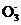 |
Cl- |
|
浓度/mol·L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ,试样的pH= 。
(2) 为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+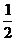 O2(g)
O2(g) H2O(g) ΔH=-241.8kJ·mol-1
H2O(g) ΔH=-241.8kJ·mol-1
C(s)+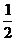 O2(g)
O2(g) CO(g) ΔH=-110.5kJ·mol-1
CO(g) ΔH=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。下列物质可作洗涤剂的是 (填字母)。
a. Ca(OH)2 b. Na2CO3 c. CaCl2 d. NaHSO3
(3) 汽车尾气中NOx和CO的生成及转化:
①已知汽缸中生成NO的反应为N2(g)+O2(g) 2NO(g) ΔH>0。
2NO(g) ΔH>0。
若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g) 2C(s)+O2(g)。
2C(s)+O2(g)。
已知该反应的ΔH>0,简述该设想能否实现的依据: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com