
3.
(1)溶液变蓝色 2Fe2++Cl2 2Fe3++2Cl-
2Fe3++2Cl-
(2)
|
实验步骤 |
预期现象和结论 |
|
步骤1:过量2 mol·L-1盐酸和1 mol·L-1
BaCl2溶液,振荡 |
|
|
步骤2:加过量1 mol·L-1 Ba(NO3)2溶液,振荡,静置 |
|
|
步骤3:0.1
mol·L-1 AgNO3溶液和过量2 mol·L-1硝酸,振荡 |
若产生白色沉淀,则B装置溶液中存在Cl- |
[若在步骤2中先加足量2 mol·L-1硝酸,再滴加过量1 mol·L-1 Ba(NO3)2溶液,振荡,静置。则在步骤3中就不需要再加入过量2 mol·L-1硝酸]
(3)②酸式滴定管 ③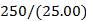 ×0.198 0×V×10-3×5或10×0.198
0×V×10-3×5
×0.198 0×V×10-3×5或10×0.198
0×V×10-3×5
2. (1)
|
实验操作 |
预期现象和结论 |
|
步骤2:滴加足量BaCl2溶液,充分振荡,静置,取上层清液于另一支试管中备用 |
有白色沉淀生成,说明产物中有Na2CO3 |
|
步骤3:将一片精密pH试纸置于表面皿上,用玻璃棒蘸取步骤2上层清液点在精密pH试纸中央,待颜色稳定后,对照比色卡读出数据 |
溶液的pH明显大于9.6,说明产物中含有Na2O |
(2)①250 mL容量瓶、玻璃棒 酚酞 锥形瓶内溶液由浅红色变成无色,且半分钟不变色
② 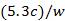 ×100%
×100%
1.
(1)①检验装置气密性 ②Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O ③漂白 ④溶液由紫红色变为无色
CuSO4+SO2↑+2H2O ③漂白 ④溶液由紫红色变为无色
(2)①S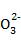 +Br2+2OH-
+Br2+2OH- S
S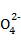 +2Br-+H2O
+2Br-+H2O
②
|
编 号 |
实验操作 |
预期现象和结论 |
|
步骤1 |
取少量待测液加入试管中,加入过量2 mol·L-1盐酸,再滴加适量1 mol·L-1
BaCl2溶液 |
|
|
步骤2 |
方法1:取步骤1中适量上层清液于试管中,加入适量氯水,观察溶液的颜色(或再加入四氯化碳,振荡,静置后观察颜色也可) |
溶液呈橙黄色,证明待测液中含Br-(或下层液体呈橙红色,证明待测液中含Br-) |
|
|
方法2:另取少量待测液于另一支试管中,加入过量2 mol·L-1盐酸,再加入少量氯水,观察溶液的颜色(或再加入四氯化碳,振荡,静置后观察颜色也可) |
溶液呈橙黄色,证明待测液中含Br-(或下层液体呈橙红色,证明待测液中含Br-) |
8. (2011·广东六校联考改编)钠是一种很活泼的金属,在工业上常用电解熔融NaCl的方法制得,其另一产物氯气的用途也十分广泛,工业上制取漂白粉就是其用途之一。
(1)请写出工业上用电解方法制取钠的化学方程式: 。
(2)工业上制取漂白粉的化学方程式为2Cl2+2Ca(OH)2 CaCl2+Ca(ClO)2+2H2O,漂白粉的有效成分是 。
CaCl2+Ca(ClO)2+2H2O,漂白粉的有效成分是 。
(3)实验室有一瓶密封不严的漂白粉,其中肯定存在CaCl2,请设计实验探究该固体中可能存在的其他物质。
①提出合理假设。
假设1:该漂白粉未变质,只含 。
假设2:该漂白粉全部变质,只含 。
假设3:该漂白粉部分变质,既含有Ca(ClO)2又含有CaCO3。
②设计实验方案,进行实验。请在下表中写出实验步骤、预期现象和结论。
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、1 mol·L-1盐酸、品红溶液、新制澄清石灰水。(提示:不必检验Ca2+和Cl-,表格可以不填满)
|
编 号 |
实验步骤 |
预期现象和结论 |
|
① |
取少量上述漂白粉于试管中, |
|
|
② |
|
|
|
② |
|
|
专题十五 化学实验探究与计算题型研究
7. (2012·苏北四市摸底)Na2S2O3是常见的化学试剂,在定量分析中用途广泛。
(1)向新制氯水中加入Na2S2O3溶液,氯水颜色变浅,再向溶液中滴加硝酸银溶液,观察到有白色沉淀产生,据此认为Na2S2O3具有还原性。该方案是否正确并说明理由: 。
(2)常用Na2S2O3溶液测定废水中Ba2+的浓度,步骤如下:取废水25.00
mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时Cr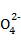 全部转化为Cr2
全部转化为Cr2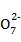 ;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010
mol·L-1 Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00 mL。部分反应的离子方程式为:①Cr2
;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010
mol·L-1 Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00 mL。部分反应的离子方程式为:①Cr2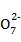 +6I-+14H+
+6I-+14H+ 2Cr3++3I2+7H2O、②I2+2S2
2Cr3++3I2+7H2O、②I2+2S2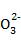
 2I-+S4
2I-+S4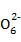 。
。
则该废水中Ba2+的物质的量浓度为 (写出计算过程)。
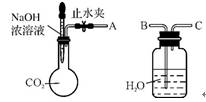
6. (2012·惠州调研)用右图所示装置可证明CO2与NaOH溶液发生了反应。
(1)将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的现象是 ,反应的离子方程式为 。
(2)向100 mL 2 mol·L-1 NaOH溶液中通入一定量CO2,充分反应后,将溶液蒸发结晶,得到少量白色固体,请设计实验确认该固体的成分。
①提出合理假设
假设1:该固体为NaOH和Na2CO3。
假设2:该固体只有Na2CO3。
假设3:该固体只有 。
假设4:该固体为 。
②请设计实验验证假设1的固体是NaOH和Na2CO3,写出实验步骤及预期的现象和结论。(步骤可不填满,也可增加)
限选的试剂和仪器:1 mol·L-1 HCl溶液、1 mol·L-1 MgCl2溶液、0.5 mol·L-1 BaCl2溶液、1 mol·L-1 Ba(OH)2溶液、甲基橙、酚酞试液,试管、胶头滴管、过滤装置。
|
实验步骤预期现象和结论 |
|
|
步骤1: |
|
|
步骤2: |
|
|
步骤3: |
|
5. (2012·潮州金山中学模拟)Fe2O3和Cu2O都是常用的红色颜料。某红色粉末可能含有Fe2O3和Cu2O,某化学实验小组通过实验来探究该红色粉末的成分。已知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
(1)提出假设
假设1:红色粉末只含Fe2O3。
假设2: 。
假设3:红色粉末是Fe2O3和Cu2O的混合物。
(2)初步探究:取少量红色粉末于小烧杯中,放入足量稀硫酸,充分搅拌后粉末全部溶解。上述三个假设中,可能成立的是 。
(3)进一步探究:完成后续实验方案的设计,填写下表中实验步骤、预期实验现象和结论(可不填满,也可补充)。
限选实验试剂:3 mol·L-1 H2SO4溶液、3 mol·L-1 NaOH溶液、0.01 mol·L-1 KMnO4溶液、20% KSCN溶液、3% H2O2溶液、淀粉-KI溶液。
|
实验步骤 |
预期现象和结论 |
|
|
|
|
|
|
4.
(2012·深圳二模)NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+ Cl2↑+H2O。某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
Cl2↑+H2O。某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
(1)该消毒液可吸收空气中的CO2生成NaHCO3而变质。写出变质过程的化学方程式: 。
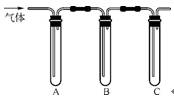
(2)取适量消毒液于试管中,加入足量一定浓度的硫酸,有气体放出。通过右图所示装置检验气体的成分可以判断消毒液是否变质。
限选试剂:98%浓硫酸、1%品红溶液、1.0 mol·L-1淀粉-KI溶液、1.0 mol·L-1 NaOH、澄清石灰水、饱和NaCl溶液。
请完成下列实验方案:
|
所加试剂 |
预期现象和结论 |
|
试管A中加足量① ; 试管B中加1%品红溶液; 试管C中加② |
若A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊。则消毒液部分变质; ③ ,则消毒液未变质;
④ ,则消毒液完全变质 |
(3)用滴定法测定消毒液中NaClO的浓度。实验步骤如下:
①量取25.00 mL消毒液放入锥形瓶中,加入过量a mol·L-1 Na2SO3溶液b mL;
②滴定分析。将c mol·L-1酸性KMnO4溶液装入 (填“酸式”或“碱式”)滴定管中;KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且保持半分钟内不褪色时,停止滴定,记录数据。重复滴定实验2次,平均消耗酸性KMnO4溶液V mL;滴定过程中涉及的反应有:
NaClO+Na2SO3 NaCl+Na2SO4
NaCl+Na2SO4
2KMnO4+5Na2SO3+3H2SO4 K2SO4+2MnSO4+5Na2SO4+3H2O
K2SO4+2MnSO4+5Na2SO4+3H2O
③计算。消毒液中NaClO的浓度为 mol·L-1(用含a、b、c、V的代数式表示)。
3. (2012·江门一模)学习小组设计了下图所示实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:
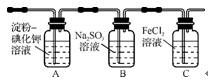
(1)通入氯气后,A装置中的现象是 。C装置中发生反应的离子方程式为 。
(2)通入氯气一段时间后,B装置溶液中有一部分S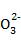 氧化成S
氧化成S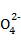 。设计实验方案检验B装置溶液中Cl-和S
。设计实验方案检验B装置溶液中Cl-和S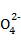 的存在。在下表中补充填写出实验步骤、预期现象和结论。(可不填满,也可补充)
的存在。在下表中补充填写出实验步骤、预期现象和结论。(可不填满,也可补充)
限选试剂及仪器:2 mol·L-1盐酸、2 mol·L-1硝酸、1 mol·L-1 BaCl2溶液、1 mol·L-1 Ba(NO3)2溶液、0.1 mol·L-1 AgNO3溶液、澄清石灰水、试管、胶头滴管。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取适量B装置中溶液于试管A中,滴加 |
若产生白色沉淀,则B装置溶液中存在S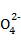 |
|
步骤2:另取适量B装置中溶液于试管B中,滴加 |
产生白色沉淀 |
|
步骤3:取步骤2后试管B中的上层清液于试管C中,滴加 |
|
|
|
|
(3)为准确测定通入氯气一段时间后剩余FeCl2的物质的量。实验操作如下:
①配制250 mL溶液:取C装置中全部溶液准确配制250 mL溶液。
②滴定:准确量取25.00
mL所配溶液于锥形瓶中,将0.198
0 mol·L-1 KMnO4溶液装入 ,滴定至终点,记录数据。重复滴定2次,平均消耗KMnO4溶液V mL。(离子方程式:Fe2++Mn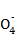 +H+
+H+ Fe3++Mn2++H2O,未配平)
Fe3++Mn2++H2O,未配平)
③计算250 mL溶液中FeCl2的物质的量= mol(只列出算式,不作运算)。
2. (2012·华南师大附中模拟)根据镁与二氧化碳的反应推测,钠也能在二氧化碳中燃烧,且固体产物可能为碳酸钠、氧化钠、碳中的两种或三种。某兴趣小组对钠在二氧化碳中燃烧后的产物进行定性和定量探究。
(1)假设产物为Na2CO3、Na2O和C的混合物,设计实验方案检验其中的Na2CO3和Na2O。写出实验步骤、预期现象和结论。(已知室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、BaCl2溶液、Ba(OH)2溶液、精密pH试纸(精确至0.1)、烧杯、试管、滴管、玻璃棒、表面皿、比色卡。
|
实验操作 |
预期现象和结论 |
|
步骤1:取适量产物样品于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,取上层清液备用 |
有不溶的黑色固体 |
|
步骤2:取适量步骤1的清液于试管中, |
|
|
步骤3: |
|
(2)假设产物为Na2CO3、Na2O和C的混合物,为进一步测定产物中Na2CO3的含量,进行以下实验:
步骤1:准确称取w g试样,溶解、过滤后准确配制成250 mL溶液。
步骤2:准确量取25.00 mL所配溶液于锥形瓶中,滴加几滴指示剂A,滴加c
mol·L-1标准盐酸至溶液的pH约为8.2(碳的主要存在形式为HC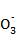 ),消耗盐酸的体积为V1
mL;再滴加几滴甲基橙,继续用上述盐酸滴至溶液由黄色变橙色,消耗盐酸的体积为V2
mL。
),消耗盐酸的体积为V1
mL;再滴加几滴甲基橙,继续用上述盐酸滴至溶液由黄色变橙色,消耗盐酸的体积为V2
mL。
步骤3:重复实验3次。滴定结果如下:
|
滴定次数 |
待测溶液的体积/mL |
消耗标准盐酸的体积 |
|
|
|
|
V1/mL |
V2/mL |
|
1 |
25.00 |
15.02 |
4.97 |
|
2 |
25.00 |
14.98 |
5.03 |
|
3 |
25.00 |
13.21 |
6.75 |
①步骤1中所需定量仪器除了天平、量筒外,还需 ;步骤2中,第一步滴定所使用的A指示剂为 ,滴定终点的现象为 。
②计算Na2CO3的质量分数= (用含w、c的代数式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com